
科目: 来源: 题型:
【题目】将5.6g铁粉放入100mLCuSO4溶液中,充分反应后,再向溶液中加入足量的稀硫酸,又产生1.12L(标准状况下)气体。试计算:
(1)和硫酸反应的铁的质量;
(2)置换出的铜的物质的量;
(3)若最后溶液总体积为250mL,求FeSO4的物质的量浓度。
查看答案和解析>>
科目: 来源: 题型:
【题目】草酸晶体(H2C2O42H2O)100℃开始失水,101.5℃熔化,150℃左右分解产生H2O、CO和CO2。用加热草酸晶体的方法获取某些气体,应该选择的气体发生装置是(图中加热装置已略去)( )
A. 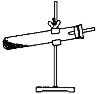 B.
B. ![]() C.
C. 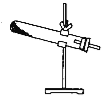 D.
D. 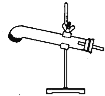
查看答案和解析>>
科目: 来源: 题型:
【题目】工业上常用铁质容器盛装冷浓硫酸。为研究铁质材料与热浓硫酸的反应,某学习小组进行了以下探究活动。
【探究一】
(1)甲同学将已去除表面氧化物的铁钉(碳素钢)放入冷浓硫酸中,10分钟后移入硫酸铜溶液中,片刻后取出观察,铁钉表面无明显变化,其原因是____________________。
【探究二】
(2)另称取铁钉6.0 g放入15.0 mL浓硫酸中,加热,充分反应后得到溶液X并收集到气体Y。乙同学取336 mL(标准状况)气体Y通入足量溴水中,发生反应:SO2+Br2+2H2O===2HBr+H2SO4然后加入足量BaCl2溶液,经适当操作后得干燥固体2.33 g。由此推知气体Y中SO2的体积分数为________。
分析上述实验中SO2体积分数的结果,丙同学认为气体Y中还可能含有H2和Q气体。为此设计了下列探究实验装置(图中夹持仪器省略):
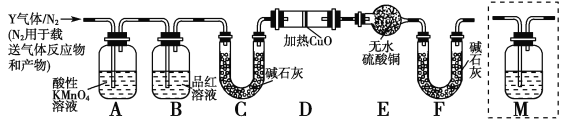
(3)装置B中试剂的作用是________。
(4)认为气体Y中还含有Q的理由是_____________________(用化学方程式表示)。
(5)为确认Q的存在,需在装置中添加M于________(选填序号)。
a.A之前 b.A—B间 c.B—C间 d.C—D间
(6)如果气体Y中含有H2,预计实验现象应是_________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】如图所示,a、b、c、d均为非金属单质,d、e均为含有10个电子的共价化合物,且分子中所含原子个数:d>e,f为离子化合物,则下列说法错误的是( )
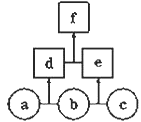
A.常温下,单质a呈气态 B.单质c具有强氧化性
C.稳定性:d>e D.f受热易分解为d和e
查看答案和解析>>
科目: 来源: 题型:
【题目】
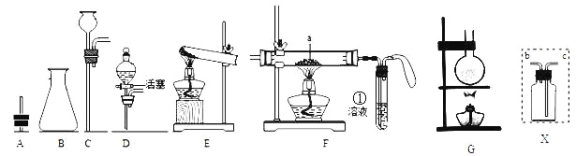
(1)用上图仪器组装成气体发生装置:制取O2可选的装置是______________。
(2)若用装置X收集制取的O2,瓶中装满水,氧气应从_____________端通入。
(3)若用F装置进行CO还原CuO的实验,实验室制取CO的方法可采取甲酸脱水法(HCOOH![]() CO↑+H2O),用纯净的CO完成该实验。
CO↑+H2O),用纯净的CO完成该实验。
I.除F、X外还需要的装置有______________,X中应加入的试剂是_________。
II.实验时①处选择的溶液可以为_______,其作用是_____________;F装置中气球的作用是____________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】电-Fenton法是用于水体中有机污染物降解的高级氧化技术,其反应原理如图所示。其中电解产生的H2O2与Fe2+发生Fenton反应:H2O2+Fe2+=Fe3++OH-+·OH,生成的羟基自由基(·OH)能氧化降解有机污染物。下列说法中正确的是

A.电源的X极为正极,Y极为负极
B.阴极的电极反应式为Fe2+-e-=Fe3+
C.阳极的电极反应式为H2O-e-=H++·OH
D.每消耗1molO2,整个电解池中理论上可产生2mol·OH
查看答案和解析>>
科目: 来源: 题型:
【题目】在密闭容器里,A与B反应生成C,其反应速率分别用v(A)、v(B)、v(C)表示,已知3v(B)=2v(A)、2v(C)=3v(B),则此反应可表示为
A. 2A+3B = 2C B. A+3B = 2C C. 3A+2B = 3C D. A+B = C
查看答案和解析>>
科目: 来源: 题型:
【题目】在一体积为10L的容器中,通入一定量的CO和H2O(g),在850℃时发生如下反应:CO(g) + H2O(g) ![]() CO2(g) + H2(g)△H<0。CO和H2O(g)浓度变化如右图
CO2(g) + H2(g)△H<0。CO和H2O(g)浓度变化如右图
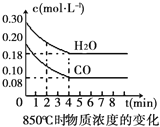
(1)0~4min的平均反应速率v(CO)=___________molL-1min-1.
(2)该条件下,此反应的平衡常数K=___________(写表达式).
(3)该反应平衡时CO的转化率为________________。
(4)能判断该反应达到化学平衡状态的依据是______________。
A.容器中压强不变 B.混合气体中c(CO)不变
C.v(H2)正=v(H2O)逆 D.c(CO2)=c(CO)
(5)t℃(高于850℃)时,在相同容器中发生上述反应,容器内各物质的浓度变化如下表.
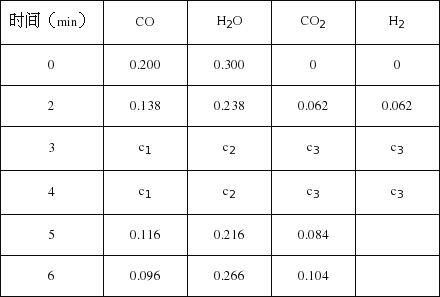
① c1数值___________0.08molL-1(填大于、小于或等于).
②反应在4min~5min间,平衡向逆方向移动,可能的原因是________________,表中5min~6min之间数值发生变化,可能的原因是_______________。
a.增加水蒸气 b.降低温度 c.使用催化剂 d.增加氢气浓度
查看答案和解析>>
科目: 来源: 题型:
【题目】(1)NaHCO3溶液中存在多种平衡关系,写出相应平衡关系所对应的离子方程式:_ _ 。
NaHCO3溶液显碱性的原因: _ 。
NaHSO4溶液显酸性的原因: 。
(2)在101kPa时,H2在1.00molO2中完全燃烧生成2.00mol液态H2O。放出571.6kJ的热量,表示H2燃烧热的热化学方程式为____________ 。
(3)1.00L 1.00mol/L H2SO4溶液与2.00L 1.00mol/L NaOH溶液完全反应,放出114.6kJ的热量,表示其中和热的热化学方程式为______________ _ 。
(4)已知C(s)+O2(g)=CO2(g) △H1=-393.5kJ/mol,
2CO(g)+O2(g)=2CO2(g) △H2=-566.0kJ/mol,
C(s)+0.5O2(g)=CO(g) △H3=akJ/mol,则a=__________
(5)已知N2(g) +3H2(g) ![]() 2NH3(g)的平衡常数为K1,0.5 N2(g)+1.5H2(g)
2NH3(g)的平衡常数为K1,0.5 N2(g)+1.5H2(g) ![]() NH3(g) 的平衡常数为K2,NH3(g)
NH3(g) 的平衡常数为K2,NH3(g) ![]() 0.5 N2(g)+1.5H2(g) 的平衡常数为K3,写出K1和K2的关系式__________,写出K2和K3的关系式____________,写出K1和K3的关系式_____________
0.5 N2(g)+1.5H2(g) 的平衡常数为K3,写出K1和K2的关系式__________,写出K2和K3的关系式____________,写出K1和K3的关系式_____________
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com