
科目: 来源: 题型:
【题目】碳及其化合物有广泛的用途。
(1)反应C(s)+H2O(g)![]() CO(g)+H2(g)ΔH=+131.3kJmol-1,达到平衡后,体积不变时,以下有利于提高H2产率的措施是 。
CO(g)+H2(g)ΔH=+131.3kJmol-1,达到平衡后,体积不变时,以下有利于提高H2产率的措施是 。
A.增加碳的用量 B.升高温度 C.用CO吸收剂除去CO D.加入催化剂
(2)已知,C(s)+CO2(g)![]() 2CO(g)△H=+172.5kJmol-1
2CO(g)△H=+172.5kJmol-1
则反应CO(g)+H2O(g)![]() CO2(g)+H2(g)的△H= kJmol-1。
CO2(g)+H2(g)的△H= kJmol-1。
(3)CO与H2一定条件下反应生成甲醇(CH3OH),甲醇是一种燃料,可利用甲醇设计一个燃料电池,用稀硫酸作电解质溶液,多孔石墨做电极,该电池负极反应式为 。
(4)在一定温度下,将CO(g)和H2O(g)各0.16 mol分别通入到体积为2.0L的恒容密闭容器中,发生以下反应:CO(g)+H2O(g) ![]() CO2(g)+H2(g),得到如下数据:
CO2(g)+H2(g),得到如下数据:
t / min | 2 | 4 | 7 | 9 |
n(H2O)/mol | 0.12 | 0.11 | 0.10 | 0.10 |
①其它条件不变,降低温度,达到新平衡前v(逆)__________v(正)(填“>”、“<”或“=”) 。
②该温度下,此反应的平衡常数K= ;
③其它条件不变,再充入0.1mol CO和0.1mol H2O(g),平衡时CO的体积分数______(填“增大”、 “减小”或“不变”)。
查看答案和解析>>
科目: 来源: 题型:
【题目】
①该学生需要量取 mL上述浓盐酸进行配制。
②配制过程中正确的操作顺序是(字母表示) 。
A.用少量水洗涤烧杯2~3次,洗涤液均注入容量瓶,振荡 |
B.用量筒准确量取所需浓盐酸,沿玻璃棒倒入烧杯中,再加入少量水,用玻璃棒慢慢搅动,使其混合均匀 |
C.将已冷却的盐酸沿玻璃棒注入500mL容量瓶中 |
D.将容量瓶盖紧、振荡、摇匀 |
E.改用胶头滴管加水,使溶液凹面恰好与刻度相切
F.继续往容量瓶内小心加水,直至液面接近刻度1~2cm处
③下列实验操作中所配制的稀盐酸的物质的量浓度偏大的有( )
a.用量筒量取浓盐酸,俯视观察,凹液面
b.定容后经振荡、摇匀、静置,发现液面下降,再加适量蒸馏水
c.稀释浓盐酸,未冷却到室温即转移到容量瓶中
d.容量瓶洗涤干净后未干燥
e.将量取浓盐酸的量筒进行洗涤,并将洗涤转移到容量瓶中
④若在标准状况下,将VL HCl气体溶解在1L水中(水的密度近似为1g/mL),所得溶液密度为![]() g/mL,则此溶液中HCl的物质的量浓度为 mol·L—1。
g/mL,则此溶液中HCl的物质的量浓度为 mol·L—1。
查看答案和解析>>
科目: 来源: 题型:
【题目】工业上用粗盐(含Ca2+、Mg2+、SO42-等杂质)为主要原料采用“侯氏制碱法”生产纯碱和化肥NH4Cl,工艺流程如下图所示。下列有关说法正确的是


A. 对粗盐溶液除杂可依次加入NaOH、Na2CO3、BaCl2,再加入盐酸调节溶液pH
B. 饱和食盐水中先通入的气体为CO2
C. 流程图中的系列操作中一定需要玻璃棒
D. 如图所示装置可以比较Na2CO3和NaHCO3晶体热稳定性
查看答案和解析>>
科目: 来源: 题型:
【题目】一定量的CuS和Cu2S的混合物投入足量的HNO3中,收集到气体VL(标准状况),向反应后的溶液中(存在Cu2+和SO42-)加入足量NaOH,产生蓝色沉淀,过滤,洗涤,灼烧,得到CuO12.0g,若上述气体为NO和NO2的混合物,且体积比为1﹕1,则V可能为
A.9.0L B.13.5L C.15.7L D.16.8L
查看答案和解析>>
科目: 来源: 题型:
【题目】如图装置闭合电键K时,电流计A的指针将发生偏转。试回答:

(1)丙池是 (填“原电池”或“电解池”),甲中a极电极名称是 ,丙中c极电极名称是 ;
(2)乙中Cu极的电极反应是______ ,若电路中有0.02mol电子通过,则甲中a电极溶解的质量为 g;
(3)闭合电键K一段时间后,丙池中生成二种气体和一种碱,则丙池中发生的总的化学方程式是 ;
(4)如果要给丙中铁片上镀上一层Cu,则丙池应作何改进 。
查看答案和解析>>
科目: 来源: 题型:
【题目】右图中电极a、b分别为Ag电极和Pt电极,电极c、d都是石墨电极。通电一段时间后,在c、d两极上共收集到336mL(标准状态)气体。请回答下列问题。
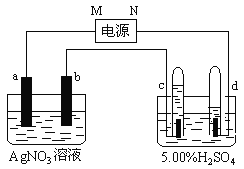
(1)直流电源中,N为 极。
(2)AgNO3溶液的浓度___________(填增大、减小或不变。下同),H2SO4溶液的pH ,若要硫酸恢复成原溶液需加入
(3)Pt电极上生成的物质是 ,其质量为 g。
查看答案和解析>>
科目: 来源: 题型:
【题目】近年来燃煤脱硫技术受到各界科研人员的重视,某脱硫技术涉及如下反应:
Ⅰ. CaSO4(s)+CO(g)![]() CaO(s)+SO2(g)+CO2(g) ΔH1=+218.4 kJ· mol-1
CaO(s)+SO2(g)+CO2(g) ΔH1=+218.4 kJ· mol-1
Ⅱ. CaO(s)+3CO(g)+SO2(g)![]() CaS(s)+3CO2(g) ΔH2=-394.0 kJ· mol-1
CaS(s)+3CO2(g) ΔH2=-394.0 kJ· mol-1
(1) 若用K1、K2分别表示反应Ⅰ、Ⅱ的化学平衡常数,则反应![]() CaSO4(s)+2CO(g)
CaSO4(s)+2CO(g)![]()
![]() CaS(s)+2CO2(g)的平衡常数K= (用含K1、K2的式子表示)。
CaS(s)+2CO2(g)的平衡常数K= (用含K1、K2的式子表示)。
(2) 某科研小组研究在其他条件不变的情况下,改变起始一氧化碳物质的量对反应Ⅱ的影响,实验结果如右图所示(图中T表示温度)。
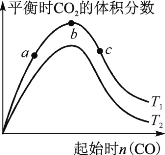
比较在a、b、c三点所处的平衡状态中,反应物SO2的转化率最高的是 。
②图像中T2 (填“高于”、“低于”、“等于”或“无法确定”)T1,判断的理由是 。
(3)反应3X+Y![]() 2Z在2 min达到平衡后的t1~t6内反应速率与反应时间图像如图,在每一时刻均改变一个影响反应速率的因素,则( )
2Z在2 min达到平衡后的t1~t6内反应速率与反应时间图像如图,在每一时刻均改变一个影响反应速率的因素,则( )

A.在t1时增大了压强 B.在t3时加入了催化剂
C.在t4时降低了温度 D.t2~t3时A的转化率最高
查看答案和解析>>
科目: 来源: 题型:
【题目】MnO2是一种重要的无机功能材料,工业上从锰结核中制取纯净的MnO2工艺流程如下图所示:

部分难溶的电解质溶度积常数(Ksp)如下表:
化合物 | Zn(OH)2 | Fe(OH)2 | Fe(OH)3 |
Ksp近似值 | 10﹣17 | 10﹣17 | 10﹣39 |
已知:一定条件下,MnO4![]() 可与Mn2+反应生成MnO2
可与Mn2+反应生成MnO2
(1)步骤Ⅱ中消耗0. 5molMn2+时,用去1molL-1的NaClO3溶液200ml,该反应离子方程式为
(2)已知溶液B的溶质之一可循环用于上述生产,此物质的名称是_____________。
(3)MnO2是碱性锌锰电池的正极材料.放电过程产生MnOOH,该电池正极的电极反应式是 。如果维持电流强度为5A,电池工作五分钟,理论消耗锌 g.(已知F=96500C/mol)
(4)向废旧锌锰电池内的混合物(主要成分MnOOH、Zn(OH)2)中加入一定量的稀硫酸和稀草酸(H2C2O4),并不断搅拌至无CO2产生为止,写出MnOOH参与反应的离子方程式 。
。向所得溶液中滴加高锰酸钾溶液产生黑色沉淀,设计实验证明黑色沉淀成分为MnO2 。
(5)用废电池的锌皮制作ZnSO47H2O的过程中,需除去锌皮中的少量杂质铁,其方法是:加入稀H2SO4和H2O2,铁溶解变为Fe3+,加碱调节pH为 时,铁刚好沉淀完全(离子浓度小于1×10﹣5molL﹣1时,即可认为该离子沉淀完全)。继续加碱调节pH为 时,锌开始沉淀(假定Zn2+浓度为0.1molL﹣1)。
查看答案和解析>>
科目: 来源: 题型:
【题目】微量元素在生物体内虽很少,却是维持正常生命活动不可缺少的,这可以通过下面哪一实例得到说明
A. Mg是叶绿素的组成成分
B. 油菜缺少硼时会出现“花而不实”
C. 动物血液钙盐含量太低会抽搐
D. 缺P会影响ATP的合成
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com