
科目: 来源: 题型:
【题目】溶液、胶体和浊液这三种分散系的本质区别是( )
A. 是否为大量分子和离子的集合体
B. 分散质粒子的大小
C. 能否通过滤纸或半透膜
D. 是否均一、稳定、透明
查看答案和解析>>
科目: 来源: 题型:
【题目】下列有关说法正确的是( )
A.氯化钠溶液均一、稳定、透明,不是分散系
B.“冰水混合物”是一种分散系
C.分散系有的是纯净物,有的是混合物
D.分散系都是混合物,按分散质和分散剂所处的状态,分散系的组合可能有9种方式
查看答案和解析>>
科目: 来源: 题型:
【题目】欲在金属表面镀银,应把镀件挂在电镀池的阴极。下列各组中,选用的阳极金属和电镀液均正确的是( )
A.Ag和AgCl溶液 B.Fe和Ag2SO4溶液
C.Ag和AgNO3溶液 D.Pt和Ag2SO4溶液
查看答案和解析>>
科目: 来源: 题型:
【题目】下列表示对应化学反应的离子方程式正确的是
A.向Al2(SO4)3溶液中加入过量NH3·H2O:Al3++4NH3·H2O===[Al(OH)4]-+4NH![]()
B. 铅酸蓄电池充电时的正极反应:PbO2+4H++SO![]() +2e-===PbSO4+2H2O
+2e-===PbSO4+2H2O
C.Fe2(SO4)3溶液与Ba(OH)2溶液反应:Fe3++SO42-+Ba2++3OH-===Fe(OH)3 ↓ + BaSO4↓
D.(NH4)2Fe(SO4)2溶液与过量NaOH溶液反应:2NH4++Fe2++4OH-===Fe(OH)2↓+2NH3·H2O
查看答案和解析>>
科目: 来源: 题型:
【题目】A、B、C、D、E、F均为短周期元素,且原子序数依次增大,A是原子半径最小的元素,B的最高价氧化物的水化物可与其氢化物反应形成离子化合物甲;A与D可以按照原子个数比4∶1形成化合物乙,且乙分子中含有18个电子,E与B同主族,C的阳离子与F的阴离子相差一个电子层,且可形成离子个数比为2∶1的离子化合物丙。
(1)E在周期表中的位置为 。
(2)下列说法正确的有 。
①化合物乙分子中只含有极性共价键
②C、D、E、F原子半径由大到小的顺序为C>D>E>F
③B、E形成的氢化物中,B的氢化物更稳定
④化合物甲和化合物丙都含有离子键和共价键
(3)将F燃烧的产物通入BaCl2和HNO3的混合溶液中,生成白色沉淀并放出无色气体,请用一个离子方程式表示该反应 。
(4)写出一个由以上元素构成的10电子微粒与18电子微粒反应的离子方程式 。
(5)A与B可形成一种二元化合物X,其中A元素质量分数为2.33%.据研究X显弱酸性。回答:
①X的电离方程式为 __。
②X电离的阴离子结构与二氧化碳相似,则其电子式为 。
查看答案和解析>>
科目: 来源: 题型:
【题目】向等物质的量浓度的HCl、AlCl3、NH4Cl、MgCl2混合溶液中逐滴加入1 mol·L-1的NaOH溶液,生成沉淀的物质的量与加入NaOH溶液的体积关系如图所示。下列有关说法正确的是
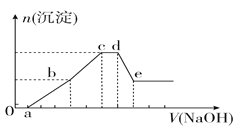
A.在0~a段加入的NaOH溶液与NH4Cl反应
B.在滴加NaOH溶液全过程中主要粒子参与反应的先后顺序是H+、Al3+、Mg2+、NH4+、Al(OH)3
C.c点溶液中溶质只有NaCl
D.在d~e段加入NaOH溶液发生反应的离子方程式为Al3++4OH-===AlO![]() +2H2O
+2H2O
查看答案和解析>>
科目: 来源: 题型:
【题目】下图中,A、B、C、D、E是单质,G、H、I、F是B、C、D、E分别和A形成的二元化合物。
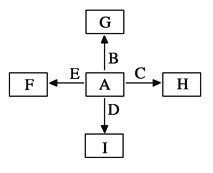
已知:①G为红棕色固体,能发生反应C+G![]() B+H,该反应会放出
B+H,该反应会放出
大量的热②I是一种常见的温室气体,它和E可以发生反应:
2E+I![]() 2F+D,F中E元素的质量分数为60%。回答问题:
2F+D,F中E元素的质量分数为60%。回答问题:
(1)①中反应的化学方程式为_____________________;
(2)化合物I的电子式为___________,它的空间构型是________________;
(3)8.0g G溶于盐酸,得到的溶液与铜粉完全反应,计算至少所需铜粉的质量____________g;
(4)C与过量NaOH溶液反应后溶液与过量化合物I反应的离子方程式为_____________;
(5)E在I中燃烧观察到的现象是_________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】联氨(又称联肼,N2H4,无色液体)是一种应用广泛的化工原料,可用作火箭燃料,回答下列问题:
(1)联氨分子的电子式为_____________,其中氮的化合价为____________。
(2)实验室可用次氯酸钠溶液与氨反应制备联氨,反应的化学方程式为___________。
(3)①2O2(g)+N2(g)=N2O4(l) △H1
②N2(g)+2H2(g)=N2H4(l) △H2
③O2(g)+2H2(g)=2H2O(g) △H3
④2N2H4(l)+ N2O4(l)=3N2(g)+4H2O(g) △H4=- 1048.9kJ/mol
上述反应热效应之间的关系式为△H4=________________,联氨和N2O4可作为火箭推进剂的主要原因为_____________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】A、B、C、D、E、F六种短周期主族元素的原子序数依次增大。A是元素周期表中原子半径最小的元素;B元素的原子最外层电子数是次外层电子数的2倍;D与A能形成两种原子个数比分别为1:1和1:2的共价化合物X和Y;D还能与E形成两种原子个数比分别为1:1和1:2的离子化合物M和N;F的最高正化合价为+6。
回答下列问题:
(1)C元素的化学名称为____________,F元素的化学名称为____________。
(2)Y的电子式为____________,M中阴离子的离子符号为___________。
(3)由以上六种元素中的两种原子构成的五核10e-分子的空间构型是______________。
(4)用电子式表示化合物E2F的形成过程为____________________。
(5)D、F的简单氢化物的沸点高低为____________(用化学式表示)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com