
科目: 来源: 题型:
【题目】已知酸性K2Cr2O7溶液可与FeSO4反应生成Fe3+和Cr3+。现将硫酸酸化的K2Cr2O7溶液与FeSO4溶液混合,充分反应后再向所得溶液中加入KI溶液,混合溶液中Fe3+的物质的量随加入的KI的物质的量的变化关系如图所示,下列说法中不正确的是( )
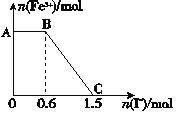
A.图中AB段的氧化剂为K2Cr2O7
B.图中BC段发生的反应为2Fe3++2I-=2Fe2++I2
C.开始加入的K2Cr2O7为0.15 mol
D.K2Cr2O7与FeSO4反应的物质的量之比为1∶6
查看答案和解析>>
科目: 来源: 题型:
【题目】某化学兴趣小组同学展开对漂白剂亚氯酸钠(NaClO2)的研究。
实验Ⅰ:制取NaClO2晶体
已知:NaClO2饱和溶液在温度低于38℃时析出的晶体是NaClO23H2O,高于38℃时析出晶体的是NaClO2,高于60℃时NaClO2分解成NaClO3和NaCl。
利用下图所示装置进行实验。
(1)装置①的作用是 装置③的作用是 。
(2)装置②中产生ClO2的化学方程式为 。装置④中产生NaClO2的化学方程式为 。
(3)从装置④反应后的溶液获得晶体NaClO2的操作步骤为:
①减压,55℃蒸发结晶;②趁热过滤;③ ;④低于60℃干燥,得到成品。
实验Ⅱ:测定某亚氯酸钠样品的纯度。
设计如下实验方案,并进行实验:
①准确称取所得亚氯酸钠样品m g于烧杯中,加入适量蒸馏水和过量的碘化钾晶体,再滴入适量的稀硫酸,充分反应(已知:ClO2-+ 4I-+4H+ =2H2O+2I2+Cl-)。将所得混合液配成100mL待测溶液。
②移取25.00mL待测溶液于锥形瓶中,用c molL-1 Na2S2O3标准液滴定,至滴定终点。重复2次,测得消耗标准溶液的体积的平均值为V mL(已知:I2 +2S2O32-=2I-+S4O62-)。
(4)滴定中使用的指示剂是 。
(5)样品中NaClO2的质量分数为 (用含m、c、V的代数式表示)。
查看答案和解析>>
科目: 来源: 题型:
【题目】用50mL0.50mol/L盐酸与50mL0.55mol/LNaOH溶液在如图所示的装置中进行中和反应。通过测定反应过程中所放出的热量可计算中和热。回答下列问题:
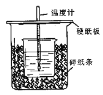
(1)仔细观察实验装置,图中是否缺少一种玻璃用品,如果缺少,缺少的是 (填仪器名称,如果不缺少,此空不填。),图中是否有不妥之处,如果有请指出 (如果没有,此空不填。)
(2)烧杯间填满碎纸条的作用是 。
(3)大烧杯上如不盖硬纸板,求得的中和热数值 (填“偏大、偏小、无影响”)
(4)用相同浓度和体积的醋酸代替盐酸溶液进行上述实验,测得的中和热△H会 ;(填“偏大”、“偏小”、“无影响”)。
(5)如果用60mL0.50mol/L盐酸与50mL0.55mol/LNaOH溶液进行反应,与上述实验相比,所放出的热量 (填“相等、不相等”),所求中和热 (填“相等、不相等”),简述理由
查看答案和解析>>
科目: 来源: 题型:
【题目】根据原子结构及元素周期律的知识,下列推断正确的是( )
A. 3517Cl2与3717Cl2氧化能力相近,二者互为同位素
B. 过氧化氢的电子式:![]()
C. 同主族元素形成的含氧酸的酸性随核电荷数的增加而减弱
D. 同周期主族元素原子半径随核电荷数的增大而减小
查看答案和解析>>
科目: 来源: 题型:
【题目】在25 ℃时,将a g NH3完全溶于水,得到V mL pH=8的氨水,假设该氨水的密度为ρ g·cm-3,溶质的质量分数为ω,其中含NH4+的物质的量为b mol,下列叙述中错误的是( )
A.溶质的质量分数为ω=![]() ×100%
×100%
B.溶质的物质的量浓度c=![]() mol·L-1
mol·L-1
C.溶液中c(OH-)=![]() mol·L-1
mol·L-1
D.上述溶液中再加入VmL水后,所得溶液的质量分数小于0.5ω
查看答案和解析>>
科目: 来源: 题型:
【题目】在Cl-的物质的量浓度为0.5molL-1的某无色澄清溶液中,还可能含有如表中所示的若干种离子.
阳离子 | K+ Al3+ Mg2+ Ba2+ Fe3 |
阴离子 | NO3- CO32- SiO32- SO42- OH- |
现取该溶液200mL进行如下实验(气体体积均在标准状况下测定).
序号 | 实验内容 | 实验结果 |
Ⅰ | 向该溶液中加入足量稀盐酸 | 产生白色沉淀并放出标准状况下0.56L气体 |
Ⅱ | 将Ⅰ的反应混合液过滤,对沉淀洗涤、灼烧至恒重,称量所得固体质量 | 固体质量为2.4g |
Ⅲ | 向Ⅱ的滤液中滴加BaCl2溶液 | 无明显现象 |
请回答下列问题.
(1)通过以上实验不能确定是否存在的离子是
(2)实验Ⅰ中生成气体的离子方程式为
(3)通过实验Ⅰ、Ⅱ、Ⅲ和必要计算,请写出一定存在的阴离子及其浓度(不一定要填满).
阴离子 | 浓度c/(mol/L) |
(4)判断K+是否存在,若存在,求出其最小浓度,若不存在说明理由: _
查看答案和解析>>
科目: 来源: 题型:
【题目】(1)完全燃烧一定质量的无水乙醇,放出的热量为QkJ,为完全吸收生成的CO2,并使之生成正盐,消耗0.8mol/L NaOH溶液50mL,则燃烧1mol酒精放出的热量是_________________。
(2)白磷与氧可发生如下反应:P4+5O2=P4O10。
已知断裂下列化学键需要吸收的能量分别为:
P-P akJ·mol-1、P-O bkJ·mol-1、
P=O ckJ·mol-1、O=O dkJ·mol-1
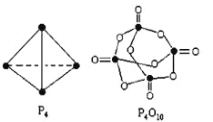
根据图示的分子结构和有关数据计算该反应的反应热__________________。
(3)现根据下列3个热化学反应方程式:
Fe2O3(s)+3CO(g)=2Fe(s)+3CO2(g) △H=-24.8kJ/mol
3Fe2O3(s)+ CO(g)=2Fe3O4(s)+ CO2(g) △H=-47.2kJ/mol
Fe3O4(s)+CO(g)=3FeO(s)+CO2(g) △H=-19.4kJ/mol
写出CO气体还原FeO固体得到Fe固体和CO2气体的热化学反应方程式:_______________。
查看答案和解析>>
科目: 来源: 题型:
【题目】金属(M)–空气电池(如图)具有原料易得、能量密度高等优点,有望成为新能源汽车和移动设备的电源。该类电池放电的总反应方程式为:4M+nO2+2nH2O=4M(OH) n。已知:电池的“理论比能量”指单位质量的电极材料理论上能释放出的最大电能。下列说法不正确的是( )

A.采用多孔电极的目的是提高电极与电解质溶液的接触面积,并有利于氧气扩散至电极表面
B.比较Mg、Al、Zn三种金属–空气电池,Al–空气电池的理论比能量最高
C.在M–空气电池中,为防止负极区沉积Mg(OH)2,宜采用中性电解质及阳离子交换膜
D.M–空气电池放电过程的正极反应式:4Mn++nO2+2nH2O+4ne–=4M(OH)n
查看答案和解析>>
科目: 来源: 题型:
【题目】除去下列物质中混有的少量杂质,所用除杂试剂及操作方法均正确的是( )
选项 | 物质 | 杂质 | 除杂试剂及操作方法 |
A | FeCl2溶液 | CuCl2溶液 | 加入过量铁粉,充分反应后过滤 |
B | KCl固体 | MnO2固体 | 加足量的水溶解、过滤、洗涤、干燥 |
C | CaO | CaCO3 | 加入适量的稀盐酸至不再生产气体为止 |
D | Cu | C | 在空气中灼烧 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com