
科目: 来源: 题型:
【题目】可逆反应2SO2(g)+O2(g)![]() 2SO3(g)从正方向开始,并达到了平衡。此时SO2和O2的物质的量之比为2∶1;若采取某种措施,导致SO2和O2又消耗了一些,并再次达到平衡,下列说法正确的是( )
2SO3(g)从正方向开始,并达到了平衡。此时SO2和O2的物质的量之比为2∶1;若采取某种措施,导致SO2和O2又消耗了一些,并再次达到平衡,下列说法正确的是( )
A .新平衡体系中,SO2和O2物质的量之比仍为2∶1
B .平衡向正反应方向移动了,原因是正反应速率增大了,逆反应速率减小了
C .新平衡体系与旧平衡体系比较,SO3的浓度肯定增大了
D .若采取的措施是缩小容器的容积,则新旧平衡中SO2和O2的转化率之比都是1∶1
查看答案和解析>>
科目: 来源: 题型:
【题目】现有稀硫酸、纯碱、二氧化碳、铜片、食盐、生石灰、铁片和木炭粉8种物质。
(1)在这8种物质中,属于电解质的有____________________
(用相应的化学式表示,下同)。
(2)这8种物质中的某5种存在下面的相互关系,选择适当的物质填入①~⑤,使有连线的两种物质能发生反应,并回答下列问题。

①它们的化学式分别为:①______________;②______________;③____________;④________________;⑤______________。
②如果连线对应的反应分别用A、B、C、D、E表示。五个反应中属于氧化还原反应的有________________个;反应A的离子方程式为_____________,反应B________________(填“属于”或“不属于”)离子反应,反应D的化学方程式为_______________。
查看答案和解析>>
科目: 来源: 题型:
【题目】下列有关物质的量和阿伏加德罗常数的说法,不正确的是
A.0.6gCaCO3和Mg3N2的混合物中所含质子数为0.3NA
B.常温常压下,22.4LCH4中所含原子数小于5NA
C.含有0.2molH2SO4的浓硫酸与足量铜加热条件下反应,转移的电子数一定小于0.2NA
D.标准状况下,22.4L苯所含碳原子的物质的量是6mol
查看答案和解析>>
科目: 来源: 题型:
【题目】某无色溶液中加入BaCl2溶液,生成不溶于稀硝酸的白色沉淀,则该溶液中( )
A.一定溶解有SO42- B.一定溶解有CO32-
C.一定溶有Ag+ D.可能是SO42-,也可能是Ag+
查看答案和解析>>
科目: 来源: 题型:
【题目】将物质的量均为3.00mol物质A、B混合于5L容器中,发生如下反应 3A+B![]() 2C,在反应过程中C的物质的量分数随温度变化如图所示:
2C,在反应过程中C的物质的量分数随温度变化如图所示:
(1)T0对应的反应速率v正__________v逆。(填“>”“<”或“=”);
(2)此反应的正反应为___________热反应。(填“吸”或“放”);
(3)X、Y两点A物质正反应速率的大小关系是Y___________X;(填“>”“<”或“=”);
(4)若Y点的C的物质的量分数为25%,则参加反应的A的物质的量为____________mol;若Y点时所耗时间为2min,则B物质的反应速率为__________mol/(L·min)。
查看答案和解析>>
科目: 来源: 题型:
【题目】如图2所示,β-紫罗兰酮是存在于玫瑰花、番茄等中的一种天然香料,它经多步反应可合成维生素A1。下列说法正确的是
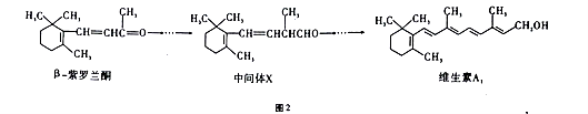
A.β-紫罗兰酮的分子式为C13H22O
B.1mol中间体X 最多能与2molBr2发生加成反应
C.维生素A1难溶于CCl4溶液
D.β-紫罗兰酮与中间体X互为同分异构体
查看答案和解析>>
科目: 来源: 题型:
【题目】锂被誉为“金属味精”,以LiCoO2为正极材料的锂离子电池已被广泛用作便携式电源。工业上常以β-锂辉矿(主要成分为LiAlSi2O6,还含有FeO、MgO、CaO等杂质)为原料来制取金属锂。其中一种工艺流程如图所示:
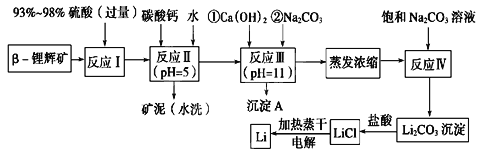
已知:①部分金属氢氧化物开始沉淀和完全沉淀时的pH如下表:
氢氧化物 | Fe(OH)3 | Al(OH)3 | Mg(OH)2 |
开始沉淀pH | 2.7 | 3.7 | 9.6 |
完全沉淀pH | 3.7 | 4.7 | 11 |
②Li2CO3在不同温度下的溶解度如下表:
温度/℃ | 0 | 10 | 20 | 50 | 75 | 100 |
Li2CO3的溶解度/g | 1.539 | 1.406 | 1.329 | 1.181 | 0.866 | 0.728 |
请回答下列问题:
(1)用氧化物形式表示LiAlSi2O6的组成:________________________。
(2)反应Ⅱ加入碳酸钙的作用是___________________。
(3)流程中两次使用碳酸钠溶液,请说明前后两次使用中浓度不同的原因:______________。
(4)洗涤所得Li2CO3沉淀要使用________(填“热水”或“冷水”),你选择的理由是________________。
(5)将盐酸与Li2CO3完全反应后的溶液,加热蒸干得到固体,再将其熔融电解生产锂。电解时产生的氯气中会混有少量氧气,原因是:__________________________。
(6)下列关于金属锂及碱金属的说法正确的是___________(填序号)。
A.锂是碱金属,其熔点高于钠 B.根据对角线原则,氢氧化锂是强碱
C.金属锂的氧化物形式十分复杂 D.碱金属中密度最小的是锂,其次是钠
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com