
科目: 来源: 题型:
【题目】现有三组溶液:①汽油和氯化钠溶液 ②39%的乙醇溶液 ③氯化钠和单质溴的水溶液,分离以上各混合液的正确方法依次是( )。
A.分液、萃取、蒸馏 B.萃取、蒸馏、分液
C.分液、蒸馏、萃取 D.蒸馏、萃取、分液
查看答案和解析>>
科目: 来源: 题型:
【题目】按要求回答下列有关问题。
(1)汽车尾气净化的主要原理为:2NO(g)+2CO(g)=N2(g)+2CO2(g);△H<0,在一定温度下,在一体积固定的密闭容器中充入一定量的NO和CO达到平衡状态。若要同时提高该反应的速率和NO的转化率,采取的措施有 、 。(写出2个)
(2)对反应N2O4(g)![]() 2NO2(g) △H>0 在温度为Tl、T2时平衡体系中NO2的体积分数随压强变化曲线如图所示,下列说法正确的是__________。
2NO2(g) △H>0 在温度为Tl、T2时平衡体系中NO2的体积分数随压强变化曲线如图所示,下列说法正确的是__________。
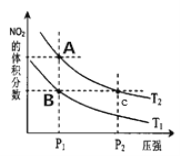
a.A、C两点的反应速率:A>C
b.A、C两点气体的颜色:A浅,C深
c.由状态A到状态B,可以用加热的方法
d.A、C两点的化学平衡常数:A>C
(3)某温度下,在一个2 L的密闭容器中,加入4 mol A和2 mol B进行如下反应:3A(g)+2B(g) ![]() 4C(?)+2D(?)。反应一段时间后达到平衡,测得生成1.6 mol C,且反应的前后压强之比为5∶4(相同的温度下测量)。则该反应的化学平衡常数:K=____________。
4C(?)+2D(?)。反应一段时间后达到平衡,测得生成1.6 mol C,且反应的前后压强之比为5∶4(相同的温度下测量)。则该反应的化学平衡常数:K=____________。
查看答案和解析>>
科目: 来源: 题型:
【题目】将一定体积密度为1.84 g/cm3、质量分数为98%的浓硫酸稀释成1 000 mL、物质的量浓度为2 mol/L的稀硫酸。求:
(1)原浓硫酸的物质的量浓度;
(2)原浓硫酸的体积。
查看答案和解析>>
科目: 来源: 题型:
【题目】将15 mL 2 mol·L1 Na2CO3溶液逐滴加入到40 mL 0.5 mol·L1 MCln盐溶液中,恰好将溶液中的Mn+ 完全沉淀为碳酸盐,则MCln中n值是
A. 4 B. 3 C. 2 D. 1
查看答案和解析>>
科目: 来源: 题型:
【题目】指定的下列变化能够实现的是
①弱酸与盐溶液反应生成强酸 ②两种氧化物发生反应有气体生成 ③两种酸的溶液充分反应后溶液呈中性 ④复分解反应中既没有生成水,也没有生成沉淀和气体
A. ①③ B. ②④ C. ①②④ D. ①②③④
查看答案和解析>>
科目: 来源: 题型:
【题目】铁铬氧化还原液流电池是一种低成本的储能电池,电池结构如下图所示,工作原理为:Fe3++Cr2+ ![]() Fe2++Cr3+。下列说法正确的是
Fe2++Cr3+。下列说法正确的是
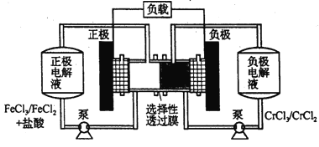
A.氧化性:Cr3+ >Fe3+
B.电池放电时,负极的电极反应式为:Fe2+-e-=Fe3+
C.充电时,阴极的电极反应式为:Cr3+ +e-= Cr2+
D.电池放电时,Cl-从负极室穿过选择性透过膜移向正极室
查看答案和解析>>
科目: 来源: 题型:
【题目】某小组用下图装置进行实验,下列说法正确的是
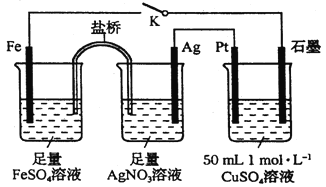
A.盐桥中的电解质可以用KCl
B.闭合K,外电路电流方向为Fe电极→石墨电极
C.闭合K,石墨电极上只生成铜
D.导线中流过0.15mol电子时,加入5.55gCu2(OH)2CO3,CuSO4溶液可恢复原组成
查看答案和解析>>
科目: 来源: 题型:
【题目】在实验室中某实验小组同学关于硫酸铜的制取和应用,设计了以下实验:

(1)装置A中发生反应的化学方程式为________________________。
(2)为符合绿色化学的要求,某同学进行如下设计:将铜粉在___________(填仪器名称)中反复的灼烧,使铜与空气充分反应生成氧化铜,再将氧化铜与稀硫酸反应,反应后溶液经过_________、___________、过滤、洗法、干燥,即可得到产品CuSO4·5H2O晶体。
(3)将空气或氧气直接通入到钢粉与稀硫酸的混合物中,发现在常温下几乎不反应。向反应液中加少量FeSO4作催化剂,即发生反应,生成硫酸铜。其反应过程的第2步是:___________,Fe3++Cu==2Fe2++Cu2+,请写出其第1步反应的离子方程式_________________。
(4)制取的CuSO4溶液和“另一物质”在40~50℃混合时生成了一种难溶物质氢化亚铜(CuH)。将CuH溶解在稀盐酸中时生成了一种气体,这种气体是 _____________,经收集测定生成的该气体为标况下11.2 L,则被还原的离子得电子的物质的量是___________。
查看答案和解析>>
科目: 来源: 题型:
【题目】Ⅰ.现有下列十种物质:①O2;②Fe;③CaO;④CO2;⑤H2SO4;⑥Ba(OH)2;⑦红褐色的氢氧化铁胶体;⑧硫酸钠溶液;⑨稀硝酸;⑩Cu2(OH)2CO3。
(1)按物质的树状分类法填写表格的空白处:
分类标准 | 金属单质 | 氧化物 | 溶液 | 胶体 |
属于该类的物质 | ② | _____ | ⑧⑨ | _____ |
(2)上述物质中属于非电解质的有_________;上述物质中能与盐酸反应的电解质有________。
Ⅱ.(1)在 KClO3+6HCl(浓)=KCl+3Cl2↑+3H2O 的反应中,氧化剂是_________,还原产物是_________,氧化产物与还原产物的质量比是_________。
(2)在反应MnO2+4HCl=MnCl2+Cl2↑+2H2O中,每生成标准状况下4.48LCl2,转移电子的数目为___________。
Ⅲ.Mn2+、Bi3+、BiO3-、MnO4-、H+、H2O组成的一个氧化还原反应体系中,发生BiO3-→Bi3+的反应过程,据此回答下列问题:
将以上物质分别填入下面对应的横线上,组成一个未配平的化学方程式。
________+ _________+ ________![]() _________+ ________+H2O
_________+ ________+H2O
查看答案和解析>>
科目: 来源: 题型:
【题目】NaNO2是一种食品添加剂,它能致癌。酸性 KMnO4溶液与 NaNO2的反应方程式是MnO4- + NO2- + □ → Mn2+ + NO3- + H2O。下列叙述中正确的是( )
A.该反应中NO2被还原
B.反应过程中溶液的pH减小
C.生成1molNaNO3需消耗0.4molKMnO4
D.□中的粒子是OH-
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com