
科目: 来源: 题型:
【题目】现有常温下的六份溶液:①0.01mol/LCH3COOH溶液;②0.01mol/LHCl溶液;③pH=12的氨水;④pH=12的NaOH溶液;⑤0.01mol/LCH3COOH溶液与pH=12的氨水等体积混合后所得溶液;⑥0.01mol/LHCl溶液与pH=12的NaOH溶液等体积混合所得溶液。
⑴其中水的电离程度最大的是 (选填序号,下同),水的电离程度相同的是 ;
⑵若将②、③混合后所得溶液pH=7,则消耗溶液的体积:② ③(选填“>”、“<”或“=”);
⑶将六份溶液同等程度稀释10倍后,溶液的pH:① ②,③ ④(选填“>”、“<”或“=”);
⑷某二元酸H2A电离方程式是H2A=H++HA-、HA-![]() A2-+H+。回答下列问题:
A2-+H+。回答下列问题:
①Na2A溶液显__________性,理由是__________(用离子方程式表示).
②若0.1mol/LNaHA溶液的pH=2,则0.1mol/LH2A溶液中氢离子的物质的量浓度可能__________0.11mol/L(填“<”、“>”或“=”)理由是______________.
③0.1mol/LNaHA溶液中各离子浓度由大到小的顺序是______________.
查看答案和解析>>
科目: 来源: 题型:
【题目】利用 Y 型管与其它仪器组合可以进行许多实验(固定装置略)。分析并回答下列问题:
(1) |
| 实验目的:验证SO2有氧化性 将胶头滴管中浓硫酸分别滴入Y型管的两个支管中,在支管交叉处实验现象为_____________; 硫化亚铁处加水的目的是_________________。 |
(2) |
| 实验目的:探究SO2与BaCl2反应产生沉淀的条件 二氧化硫通入氯化钡溶液并不产生沉淀,而通入另一种气体后可以产生白色沉淀.则右侧Y型管中应放置的药品是______(必要时可以加热),该沉淀的化学式为_______________。 |
(4) |
| 实验目的:锌铁合金中铁含量的测定 ①读取量气管中数据时,若发现水准管中的液面低于量气管中液面,应采取的措施是___________; ②若称得锌铁合金的质量为0.117g,量气管中初读数为1.00mL,末读数为45.80mL,则合金中铁的含量为_______%(保留2位小数,已折算标况)。 |
查看答案和解析>>
科目: 来源: 题型:
【题目】在一定温度下,l0mL 0.40mol/LH2O2发生催化分解。不同时刻测定生成O2的体积(已折算为标准状况)如下表。
t/min | 0 | 2 | 4 | 6 | 8 | 10 |
V(O2)/mL | 0.0 | 9.9 | 17.2 | 22.4 | 26.5 | 29.9 |
下列叙述不正确的是(溶液体积变化忽略不计)
A.0~6min的平衡反应速率:v(H2O2) ≈3.3×10-2mol/(L·min)
B. 6~10min的平衡反应速率:v(H2O2) <3.3×10-2mol/(L·min)
C. 反应到6min时, c (H2O2)=0.30mol/L
D.反应到6min时,H2O2分解了50%
查看答案和解析>>
科目: 来源: 题型:
【题目】近年来,冠以“绿色”的新概念不断产生,如绿色食品、绿色材料、绿色能源、绿色化学等,这里的“绿色”是对人类社会可持续发展战略的形象表述。“绿色化学”要求从 经济、环保和技术上设计可行的化学反应。据此,由单质镁制硝酸镁的下列 4 个方案中,你认为可行而且符合“绿色化学”要求的方案是
A.Mg![]() Mg(NO3)2
Mg(NO3)2
B.Mg![]() MgCl2
MgCl2![]() Mg(OH)2
Mg(OH)2![]() Mg(NO3)2
Mg(NO3)2
C.Mg![]() MgO
MgO![]() Mg(NO3)2
Mg(NO3)2
D.Mg![]() MgSO4
MgSO4![]() Mg(NO3)2
Mg(NO3)2
查看答案和解析>>
科目: 来源: 题型:
【题目】Na 、Fe 、Cl 是中学化学常见的元素。回答下列问题:
(1)含上述元素的常见化合物中,呈淡黄色的是 (填化学式)。
(2)焰色反应的实验中,Na元素燃烧时的焰色为 色,观察 K元素燃烧时的焰色需要透过 。
(3)实验室在制备 Fe(OH)2 时必须隔绝空气,否则发生的现象是 。
(4)Mg与碳粉和氯气在一定条件下反应可制备 MgCl2,该反应的化学方程式为 。若尾气可用足量 NaOH溶液完全吸收,则生成的盐为 (写化学式)。
(5)由 NO、H2、CO2组成的混合气体,先通过足量的 Na2O2充分反应后,再将混合气体用电火花引燃,充分反应后最终只得到质量分数为 70%的硝酸,无其他气体剩余。则原混合气体中 NO、H2、CO2的体积比为 。
查看答案和解析>>
科目: 来源: 题型:
【题目】废弃物的综合利用既有利于节约资源,又有利于保护环境。实验室利用废旧黄铜(Cu、Zn合金,含少量杂质Fe)制备胆矾晶体(CuSO4·5H2O)及副产物ZnO。制备流程图如下:
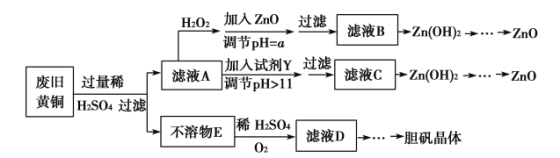
已知:Zn及化合物的性质与Al及化合物的性质相似,pH>11时Zn(OH)2能溶于NaOH溶液生成[Zn(OH)4]2-。下表列出了几种离子生成氢氧化物沉淀的pH(开始沉淀的pH按金属离子浓度为1.0 mol·L-1计算)。
Fe3+ | Fe2+ | Zn2+ | |
开始沉淀的pH | 1.1 | 5.8 | 5.9 |
沉淀完全的pH | 3.0 | 8.8 | 8.9 |
请回答下列问题:
(1)加入ZnO调节pH=a的目的是______________________,a的范围________________________。
(2)由不溶物E生成溶液D的化学方程式为____________________________。
(3)滤液A中加入H2O2反应的离子方程式为________________________________________。
(4)由溶液D制胆矾晶体包含的主要操作步骤是__________________________
(5)下列试剂可作为Y试剂的是____________。
A.ZnO B.NaOH C.Na2CO3 D.ZnSO4
若在滤液C中逐滴加入盐酸直到过量,则产生的现象是______________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】下列反应中,属于氧化还原反应同时又是吸热反应的是
A.Ba(OH)2·8H2O与NH4Cl反应
B.铝与稀盐酸
C.灼热的炭与水蒸气生成一氧化碳和氢气的反应
D.煤与O2的燃烧反应
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com