
科目: 来源: 题型:
【题目】下列事实不能用化学平衡移动原理解释的是
A.光照新制的氯水时。溶液的PH逐渐减少
B.增大压强,有利于SO2和O2反应生成SO3
C.可向浓氨水加入氢氧化钠固体快速制取氨
D.500℃左右比常温下更有利于合成氨
查看答案和解析>>
科目: 来源: 题型:
【题目】下列离子方程式与所述事实相符且正确的是( )
A. 实验室用MnO2和浓盐酸制取Cl2:MnO2+4HCl(浓)![]() Mn2++2Cl﹣+Cl2↑+2H2O
Mn2++2Cl﹣+Cl2↑+2H2O
B. Ca(HCO3)2溶液中加入少量NaOH溶液:Ca2++2HCO3-+2OH-=CaCO3↓+CO32-+2H2O
C. 向NaHSO4溶液中滴加Ba(OH)2溶液至呈中性:2H++SO42﹣+Ba2++2OH﹣=2H2O+BaSO4↓
D. 向次氯酸钠溶液中通入SO2:2ClO+SO2+H2O=SO32-+2HClO
查看答案和解析>>
科目: 来源: 题型:
【题目】下图是CO2电催化还原为CH4的工作原理示意图。下列说法不正确的是( )
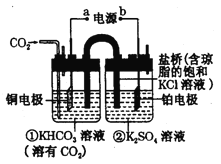
A. 该过程是电能转化为化学能的过程
B. 铜电极的电极反应式为CO2+8H++8e-=CH4+2H2O
C. 一段时间后,① 池中n(KHCO3)不变
D. 一段时间后,② 池中溶液的pH一定减小
查看答案和解析>>
科目: 来源: 题型:
【题目】铁是人类较早使用的金属之一。据有关报道,目前已经能冶炼出纯度较高的铁。你估计这种“纯铁”不会具有的性质是( )
A.硬度比生铁低
B.熔沸点比生铁高
C.能与Fe2(SO4)3溶液反应
D.不能与盐酸反应
查看答案和解析>>
科目: 来源: 题型:
【题目】【化学-选修3:物质结构与性质】氟及其氟产品在工农业生产中应用非常广泛,回答下列问题;
(l)基态氟原子核外电子的运动状态有______种,这些电子的电子云形状有_________种,氟原子的价电子排布式为______________。
(2)NaHF2(氟化氢钠)电解可制氟气,NaHF2晶体中所含作用力的类型有_______;与HF2-互为等电子体的分子有______(举一例)。
(3)三氟化硼乙醚(![]() )熔点-58℃,沸点126~129℃,它属于_____________晶体。
)熔点-58℃,沸点126~129℃,它属于_____________晶体。
(4)氟化钙晶胞结构如下图所示,晶胞参数a=0.555 nm。
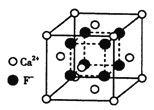
①Ca2+、F-的配位数分别为___________和___________。
②列式表示氟化钙晶体的密度________g/cm3(不必计算出结果)
查看答案和解析>>
科目: 来源: 题型:
【题目】在某100 mL的混合液中,硝酸和硫酸的物质的量浓度分别是0.4 mol·L-1、0.1 mol·L-1,向该混合液中加入1.92 g铜粉,加热,待充分反应后,所得溶液中铜离子物质的量浓度( mol·L-1)是( )
A. 0.15 B. 0.225 C. 0.35 D. 0.45
查看答案和解析>>
科目: 来源: 题型:
【题目】亚硝酸钠是重要食品添加剂。某化学兴趣小组以碳和浓硝酸为起始原料,设计如下装置利用一氧化氮与过氧化钠反应制备亚硝酸钠。(夹持装置和A中加热装置已略,气密性已检验)查阅资料:①HNO2为弱酸,室温下存在反应:3HNO2=HNO3+2NO↑+H2O;
②NO不与碱反应,可被酸性KMnO4溶液氧化为硝酸。

实验操作:
①关闭弹簧夹,打开A中分液漏斗活塞,滴加一定量浓硝酸,加热;
②一段时间后停止加热;
③从C中取少量固体,检验是否是亚硝酸钠。
回答下列问题:
(1)装置中仪器a的名称为 ,A中反应的化学方程式是 ;
(2)D装置的作用是 ;
(3)C中反应生成NaNO2的化学方程式是 ;
(4)检验C中产物有亚硝酸钠的正确操作是 (填序号) ;
a.取少量生成物溶于稀硫酸,若产生无色气体并在液体上方变为红棕色,则含有NaNO2
b.取少量生成物溶于水充分振荡,滴加酚酞试液,若溶液变红,则含有NaNO2
(5)经检验C的产物中亚硝酸钠含量较少。
①甲同学认为C中产物不仅有亚硝酸钠,还可能有其它固体物质。为排除干扰,甲在B、C装置间增加装置E,E中盛放的试剂应是 (写名称);
②乙同学认为除上述干扰因素外,还会有空气参与反应导致产品不纯,所以在实验操作①前应增加一步操作,该操作是 ;
查看答案和解析>>
科目: 来源: 题型:
【题目】在一定温度下,10mL 0.40mol·L-1H2O2溶液发生催化反应分解,不同时刻测得生成O2的体积(已折算为标准状况)如下表.
t/min | 0 | 2 | 4 | 6 | 8 | 10 |
V(O2)/mL | 0.0 | 9.9 | 17.2 | 22.4 | 26.5 | 29.9 |
下列叙述不正确的是(溶液体积变化忽略不计)
A.0~6min的平均反应速率:v(H2O2)≈3.3×10-2mol﹒L-1﹒min-1
B.6~10min的平均反应速率:v(H202)<3.3×10-2mol﹒L-1min-1
C.反应至6min时,c(H2O2)=0.30mol﹒L-1
D.反应至6min时,H2O2分解了50%
查看答案和解析>>
科目: 来源: 题型:
【题目】浓度均为0.10mol·L-1、体积均为V0的MOH和ROH分别加水稀释至体积V,pH随lg![]() 的变化如图所示,下列叙述错误的是
的变化如图所示,下列叙述错误的是
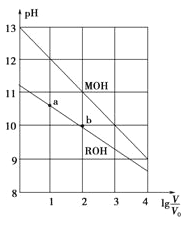
A.MOH的碱性强于ROH的碱性
B.ROH的电离程度:b点大于a点
C.若两溶液无限稀释,则它们的c(OH-)相等
D.当![]() =2时,若两溶液同时升高温度,则
=2时,若两溶液同时升高温度,则 ![]() 增大
增大
查看答案和解析>>
科目: 来源: 题型:
【题目】长式周期表共有18个纵行,从左到右排为1-18列,即碱金属为第一列,稀有气体元素为第18列。按这种规定,下列说法正确的是
A. 第9列中元素中没有非金属元素
B. 只有第二列的元素原子最外层电子排布为ns2
C. 第四周期第10列元素是铁元素
D. 第15列元素原子的最外层电子排布为ns2np5
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com