
科目: 来源: 题型:
【题目】下图是部分短周期元素原子(用字母表示)最外层电子数与原子序数的关系图。说法正确的是( )

A. X与W形成的化合物中只有共价键
B. X与Z形成的化合物中只有离子键
C. 元素的非金属性: X>R>W
D. 简单离子的半径:W>R>X
查看答案和解析>>
科目: 来源: 题型:
【题目】常温下,用0.1mol/LNaOH溶液滴定10 mL 0.1 mol/LH2A溶液,溶液的pH与NaOH溶液的体积关系如图所示。下列说法不正确的是( )

A.A点溶液中加入少量水:![]() 增大
增大
B.B点:c( HA -)>c(H+)>c(A2一)>c(H2A)
C.C点:c(Na+) =c(HA-)+2c( A2-)
D.水电离出来的c(OH -):B点>D点
查看答案和解析>>
科目: 来源: 题型:
【题目】下列离子方程式书写正确的是
A.金属铝溶于氢氧化钠溶液:Al+2OH-=AlO2-+H2↑
B.碳酸钡中加入过量盐酸:CO32-+2H+=CO2↑+H2O
C.偏酸铝钠溶液中加入过量盐酸:AlO2-+4H+=Al3++2H2O
D.铁粉加入到FeCl3溶液中:Fe+Fe3+=2 Fe2+
查看答案和解析>>
科目: 来源: 题型:
【题目】某实验小组进行物质漂白性的实验探究
Ⅰ.应用下图所示的方法实验,其中气体A的主要成分是氯气,杂质是空气和水蒸气。回答下列问题:
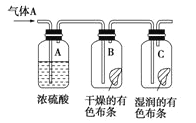
(1)该项研究(实验)的主要目的是___________________。
(2)浓硫酸的作用是____________,与研究目的直接相关的实验现象是__________________________。
(3)将石蕊试液滴到新制氯水中的现象_______________________。
Ⅱ.为探究SO2的漂白是SO2直接作用于有色物质,还是SO2与水反应的产物H2SO3的作用,设计如图装置进行实验:(图中所用硫酸的质量分数为70%)
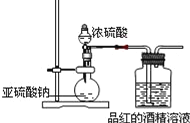

(1)为探究干燥的SO2 能不能使品红褪色,请指出设计的实验装置图中两个明显的不足中的一个______________
(2)按照修改后的装置,实验中控制SO2以大约每秒3个气泡的速度通过品红的酒精溶液时,经过一小时后,品红仍不褪色.这说明品红褪色的原因不是SO2直接导致.所以,SO2 通过品红水溶液后,引起品红褪色的可能是________.(填化学式)
查看答案和解析>>
科目: 来源: 题型:
【题目】氮化铝(AIN,遇水易水解)广泛应用于集成电路生产领域。某研究小组利用氮气、氧化铝和活性炭制取氮化铝,设计如图1所示实验装置。
请回答:
(1)图1中用饱和NaNO2溶液与NH4Cl溶液加热制取氮气,该化学方程式为 。
(2)图1装置中各仪器导管口连接的顺序是(用小写字母a→g填写): ;导管A的作用是 。
(3)按(2)连接好实验装置后,接下来的操作是 。
(4)按(2)连接的实验装置存在的缺陷是 。
(5)反应结束后,某同学用图2装置进行实验来测定 氮化铝样品的质量分数(实验中导管体积忽略不计)。
①氮化铝与过量的NaOH溶液反应生成氨气化学反应方程式为 ;
② 集气瓶中的苯的作用是 ;集气瓶中的液体没有装满,则实验测得NH3的体积将 (填“偏大”、“偏小”、“不变”)。
③若实验中称取氮化铝样品的质量为10.0 g,测得氨气的体积3. 36 L(标准状况),则样品中AlN的质量分数为 (保留3位有效数字)。
查看答案和解析>>
科目: 来源: 题型:
【题目】化学反应方程式是化学学习的基本工具,本期在化学反应与化学平衡章节学过几个重要的化学方程式,请你按要求写出:
(1)硫代硫酸钠与稀硫酸溶液反应的离子方程式:
(2)碘化钾的稀硫酸溶液与空气中氧气反应的离子方程式:
(3)在重铬酸钾的硫酸溶液中的Cr2O72—与CrO42—之间转化的离子方程式:
查看答案和解析>>
科目: 来源: 题型:
【题目】为了有效控制雾霾,各地积极采取措施改善大气质量,研究并有效控制空气中的氮氧化物含量、使用清洁能源显得尤为重要。
(1)已知:4NH3(g)+5O2(g)![]() 4NO(g)+6H2O(g) H = -905.48 kJ·mol-1
4NO(g)+6H2O(g) H = -905.48 kJ·mol-1
N2(g)+O2(g)![]() 2NO(g) H = +180.50 kJ·mol-1
2NO(g) H = +180.50 kJ·mol-1
则4NH3(g)+6NO(g)![]() 5N2(g)+6H2O(g)的H = 。
5N2(g)+6H2O(g)的H = 。
(2)某化学小组查阅资料知2NO(g)+O2(g)![]() 2NO2(g)的反应历程分两步:
2NO2(g)的反应历程分两步:
第一步:2NO(g)![]() N2O2(g) (快) H1<0 v1正=k1正c2(NO) ;v1逆=k1逆c(N2O2)
N2O2(g) (快) H1<0 v1正=k1正c2(NO) ;v1逆=k1逆c(N2O2)
第二步:N2O2(g)+O2(g)![]() 2NO2(g) (慢) H2< 0
2NO2(g) (慢) H2< 0
v2正=k2正c(N2O2)c(O2);v2逆=k2逆c2(NO2)
① 2NO(g)+O2(g)![]() 2NO2(g)的反应速率主要是由_______(填“第一步”或“第二步”)反应决定。
2NO2(g)的反应速率主要是由_______(填“第一步”或“第二步”)反应决定。
② 一定温度下,反应2NO(g)+O2(g)![]() 2NO2(g)达到平衡状态,请写出用k1正、k1逆、k2正、k2逆表示的平衡常数表达式K= ;升高温度,K值 (填“增大”、“减 小”或“不变”)
2NO2(g)达到平衡状态,请写出用k1正、k1逆、k2正、k2逆表示的平衡常数表达式K= ;升高温度,K值 (填“增大”、“减 小”或“不变”)
(3)利用活性炭涂层排气管处理NOx的反应为:xC(s)+2NOx(g)![]() N2(g)+xCO2(g) △H <0;理论上,适当增加汽车排气管(内壁为活性炭涂层)长度______(填“能”或“不能”)使NOx更加有效地转化为无毒尾气而排放,其原因是 。
N2(g)+xCO2(g) △H <0;理论上,适当增加汽车排气管(内壁为活性炭涂层)长度______(填“能”或“不能”)使NOx更加有效地转化为无毒尾气而排放,其原因是 。
(4)一定量的CO2与足量的碳在体积可变的恒压密闭容器中反应: C(s)+CO2(g)![]() 2CO(g)。平衡时,体系中气体体积分数与温度的关系如图所示,则800℃时,反应达平衡时CO2的转化率为________(保留一位小数)。
2CO(g)。平衡时,体系中气体体积分数与温度的关系如图所示,则800℃时,反应达平衡时CO2的转化率为________(保留一位小数)。

(5)氢气是一种重要的清洁能源,Mg2Cu是一种储氢合金。350℃时,Mg2Cu与H2反应,生成MgCu2和仅含一种金属元素的氢化物(其中氢的质量分数为0.077)。Mg2Cu与H2反应的化学方程式为 。
查看答案和解析>>
科目: 来源: 题型:
【题目】下列叙述中正确的是 ( )
A.氯化铝溶液中加入过量氨水反应的实质:Al3++3NH3·H2O===Al(OH)3↓+3NH![]()
B.在加入铝粉能放出氢气的溶液中,K+、NH![]() 、CO
、CO![]() 、Cl-一定能够大量共存
、Cl-一定能够大量共存
C.镁铝合金既可完全溶于过量盐酸又可完全溶于过量NaOH溶液
D.依据铝热反应原理,能发生反应2Al+3MgO ![]() 3Mg+Al2O3
3Mg+Al2O3
查看答案和解析>>
科目: 来源: 题型:
【题目】50mL 0.5mol·L-1盐酸与50mL 0.55mol·L-1 NaOH溶液在如图所示的装置中进行中和反应。通过测定反应过程中所放出的热量可计算中和热。回答下列问题:
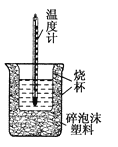
(1)从实验装置上看,图中尚缺少一种玻璃仪器是__________。
(2)大烧杯上如不盖硬纸板,测得的中和热________(填“偏大”或“偏小”或“无影响”)。
(3)实验中改用60mL 0.50mol·L-1盐酸跟50mL 0.50mol·L-1 NaOH溶液进行反应,与上述实验相比,所放出的热量________(填“偏大”或“相等”或“偏小”),所求中和热________(填“相等”或“不相等”),简述理由:_________________________。
(4)用相同浓度和体积的氨水代替NaOH溶液进行上述实验,测得的中和热数值会________;用50mL 0.5mol·L-1盐酸与50mL 0.50mol·L-1 NaOH溶液进行中和测定,测得的中和热数值会________。(填“偏大”、“偏小”或“无影响”)
(5)取50 mL 0.50 mol/L NaOH溶液和30 mL0.50 mol/L硫酸溶液进行实验,实验数据如下表。
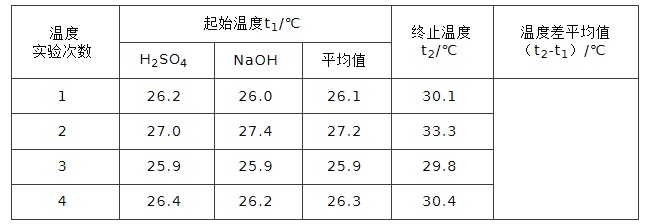
则中和热ΔH= (取小数点后一位)。(本题中NaOH溶液和硫酸溶液的密度均取1g/mL,溶液的比热容均取4.2J/(g.℃))
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com