
科目: 来源: 题型:
【题目】某溶液中只含有K+、NH4+、Ba2+、SO42-、I-、S2-中的几种,分别取样:①用pH计测试,溶液显弱酸性;②加氯水和淀粉无明显现象。为确定该溶液的组成,还需检验的离子是
A. K+ B. SO42- C. Ba2+ D. NH4+
查看答案和解析>>
科目: 来源: 题型:
【题目】反应A(g)+B(g)![]() C(g) +D(g)发生过程中的能量变化如图,△H 表示反应的焓变。下列说法正确的是
C(g) +D(g)发生过程中的能量变化如图,△H 表示反应的焓变。下列说法正确的是
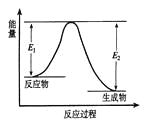
A. 反应体系中加入催化剂,反应速率增大,E1减小,E2增大
B. 反应体系中加入催化剂,反应速率增大,△H不变
C. △H < 0,反应达到平衡时,升高温度,A的转化率增大
D. △H > 0,反应达到平衡时,升高温度,A的转化率减少
查看答案和解析>>
科目: 来源: 题型:
【题目】一定条件下,向密闭恒容容器中加入1.0 mol·L-1X,发生反应:2X(g) ![]() Y(g)+Z(g) △H<0,反应到8min时达到平衡;在14min时改变体系的温度, 16min时建立新平衡。X的物质的量浓度变化如图所示。下列有关说法正确的是
Y(g)+Z(g) △H<0,反应到8min时达到平衡;在14min时改变体系的温度, 16min时建立新平衡。X的物质的量浓度变化如图所示。下列有关说法正确的是
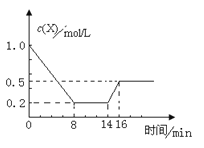
A.0~8min用Y表示该反应速率为0.1mol·L-1·min-1
B.8min时达到平衡,该反应的平衡常数为K= 0.5
C.14min时,改变的反应条是降低了温度
D.16min时的正反应速率比8min时的正反应速率大
查看答案和解析>>
科目: 来源: 题型:
【题目】Zn还原SiCl4的反应如下:
SiCl4(g)+2Zn(l)![]() Si(s)+2ZnCl2(g)ΔH1
Si(s)+2ZnCl2(g)ΔH1
SiCl4(g)+2Zn(g)![]() Si(s)+2ZnCl2(g)ΔH2
Si(s)+2ZnCl2(g)ΔH2
下列说法正确的是
A.Zn(l)=Zn(g)ΔH=1/2(ΔH1-ΔH2)
B.用硅制作的太阳能电池是将化学能转化为电能
C.增加Zn(g)的量,ΔH2变大
D.以Zn片、铜片和稀硫酸构成的原电池,Zn片表面有气泡产生。
查看答案和解析>>
科目: 来源: 题型:
【题目】(1)常温下某溶液中由水电离出的离子浓度符合c(H+)·c(OH﹣)=1×10﹣20的溶液,其pH为 ,此时水的电离受到 .
(2)在某温度下,H2O的离子积常数为1×10﹣13 mol2·L﹣2,则该温度下:100mL 0.1mol·L﹣1H2SO4溶液与100mL 0.4mol·L﹣1的KOH溶液混合后,pH= .
(3)已知一溶液有4种离子:X+、Y﹣、H+、OH﹣,下列分析结果肯定错误的是 .
A.c(Y﹣)>c(X+)>c(H+)>c(OH﹣)
B.c(X+)>c(Y﹣)>c(OH﹣)>c(H+)
C.c(H+)>c(Y﹣)>c(X+)>c(OH﹣)
D.c(OH﹣)>c(X+)>c(H+)>c(Y﹣)
(4)在25℃下,将a mol·L﹣1的氨水与0.01mol·L﹣1的盐酸等体积混合,反应时溶液中c(NH4+)=c(Cl﹣).则溶液显 (填“酸”“碱”或“中”)性;用含a的代数式表示NH3·H2O的电离常数Kb= .
(5)水溶液中的行为是中学化学的重要内容.已知下列物质的电离常数值:HClO:Ka=3×10﹣8;H2CO3:Ka1=4.3×10﹣7;Ka2=5.6×10﹣11;84消毒液中通入少量的CO2,该反应的化学方程式为 .
查看答案和解析>>
科目: 来源: 题型:
【题目】在2L的密闭绝热容器中,X、Y、Z三种气体的物质的量随时间变化的曲线如图所示。下列叙述不正确的是
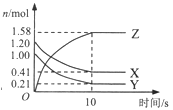
A. 反应开始到10s时,转化率:Y>X
B. 若前10s容器内的压强增加,说明生成Z的反应为放热反应
C. 由图像可知前10s内生成Z的速率越来越快
D. 若X为紫色,Y、Z无色,则10s后混合气体颜色不再变化
查看答案和解析>>
科目: 来源: 题型:
【题目】pH=2的A、B两种酸溶液各1 mL,分别加水稀释到1000 mL,其溶液的pH与溶液体积(V)的关系如图所示,则下列说法正确的是 ( )
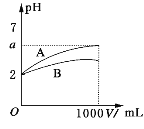
A.A、B两种酸溶液物质的量浓度一定相等
B.A一定是强酸,B一定是弱酸
C.稀释后A酸溶液的酸性比B酸溶液强
D.若A、B都是弱酸,则5>a>2
查看答案和解析>>
科目: 来源: 题型:
【题目】0.5L 1mol/L FeCl3溶液与0.2L1mol/L KCl溶液中的Cl-的数目之比( )
A. 5:2 B. 3:1 C.15:2 D. 1:3
查看答案和解析>>
科目: 来源: 题型:
【题目】元素周期表中某区域的一些元素多用于制造半导体材料,它们是( )
A.碱土金属元素
B.元素周期表中第3~12列的过渡元素
C.金属元素和非金属元素分界线附近的元素
D.左下方区域的金属元素
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com