
科目: 来源: 题型:
【题目】【2017届福建省四地六校高三上学期12月月考】
由N2O和NO反应生成N2和NO2的能量变化如图所示。下列说法正确的是( )
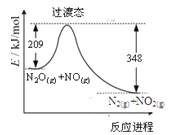
A.断键吸收能量之和大于成键释放能量之和
B.反应物总能量小于生成物总能量
C.N2O(g) +NO(g) =N2(g) +NO2(g)△H= -139kJ/mol
D.反应生成1 mol N2时转移4 mol电子
查看答案和解析>>
科目: 来源: 题型:
【题目】下列事实,不能用勒夏特列原理解释的是( )
A.在合成氨的工业生产中要及时将生成的氨分离出去
B.对 2HI(g) H2(g)+I2(g)平衡体系,增大压强可使颜色变深
C.溴水中有下列平衡 Br2+H2OHBr+HBrO,当加入 AgNO3 溶液后,溶液颜色变浅
D.合成氨反应,为提高氨的产率,理论上不宜采用高温
查看答案和解析>>
科目: 来源: 题型:
【题目】【2017宝山区二模】在密闭容器中,反应2SO2(g)+O2(g)=2SO3(g) 达到平衡后,若将容器体积缩小一半,对反应产生的影响是( )
A.V(正)减小,V(逆)增大 B.V(正)增大,V(逆)减小
C.V(正)、V(逆)都减小 D.V(正)、V(逆)都增大
查看答案和解析>>
科目: 来源: 题型:
【题目】下列说法正确的是
A. 容量瓶和分液漏斗使用前必须要检漏并干燥
B. 蒸馏操作时,温度计水银球应插入液面下
C. 检验Fe2+、Fe3+、Cl-溶液中的Fe2+,加入酸性高锰酸钾看是否褪色
D. 做过碘升华的圆底烧瓶可以用酒精洗涤
查看答案和解析>>
科目: 来源: 题型:
【题目】已知0.1 mol·L-1 的醋酸溶液中存在电离平衡: CH3COOH![]() CH3COO-+H+,要使溶液中 c(H+)/c(CH3COOH)值增大,可以采取的措施是( )
CH3COO-+H+,要使溶液中 c(H+)/c(CH3COOH)值增大,可以采取的措施是( )
A.加少量烧碱溶液 B.降低温度 C.加少量冰醋酸 D.加水
查看答案和解析>>
科目: 来源: 题型:
【题目】有A、B、C、D、E、F六种短周期的元素,原子序数依次增大,其中A、D元素的原子最外电子层均只有一个电子,且A是所有元素中原子半径最小的;C、F同主族,B元素位于元素周期表中第二周期,且原子最外层电子数占核外电子总数的3/4,F元素原子最外电子层比同周期的E元素原子的最外电子层多4个电子,E的最高价氧化物对应的水化物既能溶于强酸又能溶于强碱。请问答以下问题:
(1)写出C的元素符号_____,写出F在元素周期表中的位置_______。
(2)写出B、D、E三种元素组成的常见化合物的名称___________。
(3)写出E、F两种元素最高价氧化物对应水化物相互反应的离子方程式_______________。(4)工业生产E的化学方程式为_____________。
查看答案和解析>>
科目: 来源: 题型:
【题目】一定条件下硝酸铵受热分解的化学方程式为:5NH4NO3=2HNO3+4N2+9H2O,在反应中被氧化与被还原的氮原子数之比为
A. 5∶4
B. 5∶3
C. 3∶5
D. 1∶1
查看答案和解析>>
科目: 来源: 题型:
【题目】【2017绍兴模拟】下列关于反应速率的说法错误的是( )
A.反应速率用于衡量化学反应进行的快慢
B.可逆反应达到化学平衡状态时,正、逆反应速率都为0
C.决定反应速率的主要因素是反应物的性质
D.增大反应物浓度,提高反应温度都能增大反应速率
查看答案和解析>>
科目: 来源: 题型:
【题目】Ⅰ.请回答:
(1)H2O2的电子式___________。
(2)镁燃烧不能用CO2灭火,用化学方程式表示其理由________________。
(3)在AgCl沉淀中加入KBr溶液,白色沉淀转化为淡黄色沉淀,写出反应的离子方程式_____________。
(4)完成以下氧化还原反应的离子方程式:
( )MnO4-+( )C2O42-+______=( )Mn2++( )CO2↑+________
Ⅱ.(12分) 化合物甲和NaAlH4都是重要的还原剂。一定条件下金属钠和H2反应生成甲。甲与水反应可产生H2,甲与AlCl3反应可得到NaAlH4。将4.80g甲加热至完全分解,得到金属钠和2.24 L(已折算成标准状况)的H2。
请推测并回答:
(1)甲的化学式__________。
(2)甲与AlCl3反应得到NaAlH4的化学方程式__________。
(3)NaAlH4与水发生氧化还原反应的化学方程式__________。
(4)甲在无水条件下可作为某些钢铁制品的脱锈剂(铁锈的成分表示为Fe2O3),脱锈过程发生反应的化学方程式 。
(5)某同学认为:用惰性气体赶尽反应体系中的空气,将铁和盐酸反应后的气体经浓硫酸干燥,再与金属钠反应,得到固体物质即为纯净的甲;取该固体物质与水反应,若能产生H2,即可证明得到的甲一定是纯净的。
判断该同学设想的制备和验纯方法的合理性并说明理由___________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com