
科目: 来源: 题型:
【题目】已知草酸是二元弱酸,0.2mol/L NaHC2O4溶液显酸性,关于NaHC2O4溶液中离子浓度关系的叙述不正确的是
A.c(Na+)>c(HC2O4—)>c(C2O42—)>c(H2C2O4)
B.c(Na+)=c(HC2O4—)+c(C2O42—)+c(H2C2O4)
C.c(Na+)+c(H+)=c(HC2O4—)+c(C2O42—)+c(OH-)
D.c(H+)+c(H2C2O4)=c(C2O42—)+c(OH-)
查看答案和解析>>
科目: 来源: 题型:
【题目】在一个不导热的密闭反应器中,只发生两个反应:
a(g)+b(g)![]() 2c(g);△H1<0
2c(g);△H1<0
x(g)+3y(g)![]() 2z(g);△H2>0
2z(g);△H2>0
进行相关操作且达到平衡后(忽略体积改变所作的功),下列叙述错误的是
A.等压时,通入惰性气体,c的物质的量不变
B.等压时,通入z气体,反应器中温度升高
C.等容时,通入惰性气体,各反应速率不变
D.等容时,通入z气体,y的物质的量浓度增大
查看答案和解析>>
科目: 来源: 题型:
【题目】某学生的实验报告所列出的下列数据中合理的是
A.用10mL量筒量取7.13 mL稀盐酸
B.用托盘天平称量25.20 g NaCl
C.用广泛pH试纸测得某溶液的pH为2.3
D.用25mL滴定管做中和滴定时,用去某浓度的碱溶液21.70 mL
查看答案和解析>>
科目: 来源: 题型:
【题目】新近出版的《前沿科学》杂志刊发的中国环境科学研究院研究员的论文《汽车尾气污染及其危害》,其中系统地阐述了汽车尾气排放对大气环境及人体健康造成的严重危害。目前降低尾气的可行方法是在汽车排气管上安装催化转化器。NO和CO气体均为汽车尾气的成分,这两种气体在催化转换器中发生反应:(其中a、b、c均为正值)2CO(g)+2NO(g)![]() N2(g)+2CO2(g) △H=-a kJ·mol-1。
N2(g)+2CO2(g) △H=-a kJ·mol-1。
(1)CO2的电子式为 。
(2)已知2NO(g)+O2(g)=2NO2(g) △H=-b kJ·mol-1;CO的燃烧热△H=-c kJ·mol-1。书写在消除汽车尾气中NO2的污染时,NO2与CO的可逆反应的热化学反应方程式 。
(3)在一定温度下,将2.0mol NO、2.4mol气体CO通入到固定容积为2L的容器中,反应过程中部分物质的浓度变化如图所示:
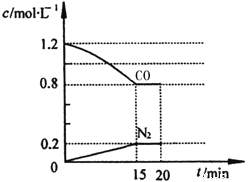
①有害气体NO的转化率为 ,0~15min NO的平均速率v(NO)= 。
②20min时,若改变反应条件,导致CO浓度减小,则改变的条件可能是 (选填序号)。
a.缩小容器体积 b.增加CO的量 c.降低温度 d.扩大容器体积
③若保持反应体系的温度不变,20min时再向容器中充入NO、N2各0.4mol,化学平衡将 移动(选填“向左”、“向右”或“不”), 移动后在达到平衡时的平衡常数是 。
查看答案和解析>>
科目: 来源: 题型:
【题目】【2015安徽卷】汽车尾气中,产生NO的反应为:N2(g)+O2(g)![]() 2NO(g),一定条件下,等物质的量的N2(g)和O2(g)在恒容密闭容器中反应,下图曲线a表示该反应在温度T下N2的浓度随时间的变化,曲线b表示该反应在某一起始条件改变时N2的浓度随时间的变化。下列叙述正确的是( )
2NO(g),一定条件下,等物质的量的N2(g)和O2(g)在恒容密闭容器中反应,下图曲线a表示该反应在温度T下N2的浓度随时间的变化,曲线b表示该反应在某一起始条件改变时N2的浓度随时间的变化。下列叙述正确的是( )
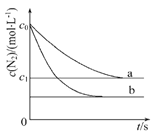
A.温度T下,该反应的平衡常数K=![]()
B.温度T下,随着反应的进行,混合气体的密度减小
C.曲线b对应的条件改变可能是加入了催化剂
D.若曲线b对应的条件改变是温度,可判断该反应的△H<0
查看答案和解析>>
科目: 来源: 题型:
【题目】高铁酸盐在能源、环保等方面有着广泛的用途。湿法、干法制备高铁酸盐的原理如下表所示。
湿法 | 强碱性介质中,Fe(NO3)3与NaClO反应生成紫红色高铁酸盐溶液 |
干法 | Fe2O3、KNO3、KOH混合加热共熔生成紫红色高铁酸盐和KNO2等产物 |
(1)工业上用湿法制备高铁酸钾(K2FeO4)的流程如下图所示:
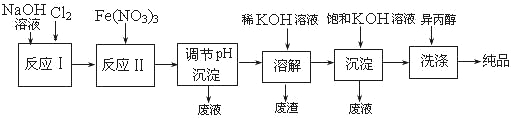
①洗涤粗品时选用异丙醇而不用水的理由是: 。
②反应Ⅱ的离子方程式为 。
③高铁酸钾在水中技能消毒杀菌,又能净水,是一种理想的水处理剂,它能消毒杀菌是因为 ,它能净水的原因是因为 。
④已知25℃时Fe(OH)3的Ksp = 4.0×10-38,反应II后的溶液c(Fe3+)=4.0×10-5mol/L,则需要调整到 时,开始生成Fe(OH)3(不考虑溶液体积的变化)。
(2)由流程图可见,湿法制备高铁酸钾时,需先制得高铁酸钠,然后再向高铁酸钠中加入饱和KOH溶液,即可析出高铁酸钾。
①加入饱和KOH溶液的目的是 。
②由以上信息可知:高铁酸钾的溶解度比高铁酸钠 (填“大”或“小”)。
(3)干法制备K2FeO4的反应中氧化剂与还原剂的物质的量之比为 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com