
科目: 来源: 题型:
【题目】用某种仪器量一液体体积时,平视读数为 V1mL,仰视读数为 V2mL,俯视读数为 V 3 mL, 若 V 3 >V 1>V 2,则所使用仪器可能是( )
A.容量瓶 B.量筒 C.碱式滴定管 D.以上仪器均可
查看答案和解析>>
科目: 来源: 题型:
【题目】关于中和热的测定实验,下列说法正确的是 ( )
A.为了使反应进行的更完全,可以使酸或碱适当过量
B.为了使反应充分,可以向酸(碱)中分次加入碱(酸)
C.中和热为一定值,实验结果与所用酸(碱)的用量和种类均无关
D.用铜丝代替玻璃棒搅拌,会使中和热测定值偏大
查看答案和解析>>
科目: 来源: 题型:
【题目】将4 mol A气体和2 mol B气体在2L 的容器中混合发生如下反应:2A(g)+B(g) ![]() 2C(g)若经2s 后测得C的浓度为0.6molL-1现有下列几种说法其中不正确的是( )
2C(g)若经2s 后测得C的浓度为0.6molL-1现有下列几种说法其中不正确的是( )
A. 用物质A表示的反应的平均速率为0.3 molL-1s-1
B. 2s时的压强是起始时的1.1倍
C. 2s时物质A的转化率为30%
D. 2s时物质B的浓度为0.7 molL-1
查看答案和解析>>
科目: 来源: 题型:
【题目】在容积为2升的密闭容器中,有反应mA(g)+nB(g)![]() pC(g)+qD(g),经过5分钟达到平衡,此时,各物质的变化为A减少了a mol·L-1,B的平均反应速度VB=a/15mol·L-1·min-1,C增加了2a/3 mol·L-1,这时若增加系统压强,发现A与C的百分含量不变,则m︰n︰p︰q为( )
pC(g)+qD(g),经过5分钟达到平衡,此时,各物质的变化为A减少了a mol·L-1,B的平均反应速度VB=a/15mol·L-1·min-1,C增加了2a/3 mol·L-1,这时若增加系统压强,发现A与C的百分含量不变,则m︰n︰p︰q为( )
A.3︰1︰2︰2 B.1︰3︰2︰2
C.1︰3︰2︰1 D.1︰1︰1︰1
查看答案和解析>>
科目: 来源: 题型:
【题目】如图所示是在实验室进行氨气快速制备与性质实验的组合装置,部分固定装置未画出。
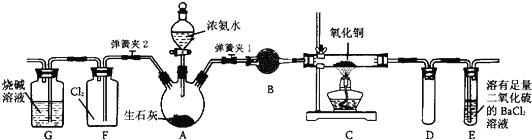
(1)在组装好装置后,若要检验A—E装置的气密性,其操作是首先 ,然后微热A,察到E中有气泡冒出,移开酒精灯或松开双手,E中导管有水柱形成说明装置气密性良好。
(2)装置B中盛放试剂是 。
(3)点燃C处酒精灯,关闭弹簧夹2,打开弹簧夹1,从分液漏斗放出浓氨水至浸没烧瓶中固体后关闭分液漏斗,稍后片刻,装置C中黑色固体逐渐变红,装置E中溶液里出现大量气泡,同时产生(答现象);从E中逸出液面的气体可以直接排入空气,请写出在C中发生反应的化学方程式 。
(4)当C中固体全部变红色后,关闭弹簧夹1,慢慢移开酒精灯,待冷却后,称量C中固体质量。若反应前固体质量为16g,反应后称重固体质量减少2.4g。通过计算确定该固体产物的成分是 (用化学式表示)。
(5)在关闭弹簧夹1后,打开弹簧夹2,残余气体进入F中,很快发现装置F中产生白烟,同时发现G中溶液迅速倒吸流入F中。写出产生白烟的化学方程式 。迅速产生倒吸的原因是。
查看答案和解析>>
科目: 来源: 题型:
【题目】用含钴废料(主要成分为Co,含有一定量的Ni、Al203、Fe、SiO2等)制备草酸钴晶体(CoC2O4·2H2O)的工业流程如图。己知:①草酸钴晶体难溶于水②RH为有机物(难电离)

(1)滤渣I的主要成分是______(填化学式),写出一种能提高酸浸速率的措施_______。
(2)操作① 用到的主要仪器有________________。
(3)H2O2是一种绿色氧化剂,写出加入H2O2后发生反应的离子方程式__________。
(4)加入氧化钴的目的是__________。
(5)草酸钴晶体分解后可以得到多种钴的氧化物(其中Co的化合价为+2、+3),取一定量钴的氧化物,用280mL 5mol/L盐酸恰好完全溶解,并得到CoCl2溶液和2.24L(标准状况)黄绿色气体,由此可确定该钴氧化物中Co、O的物质的量之比为_________。
(6)实验室可以用酸性KMnO4标准液滴定草酸根离子(C2O42-),测定溶液中C2O42-的浓度,写出此反应的离子方程式_________;KMnO4 标准溶液常用硫酸酸化,若用盐酸酸化,会使测定结果________(填“偏高”、“偏低”或“无影响”)。
查看答案和解析>>
科目: 来源: 题型:
【题目】谢弗勒尔盐(Cu2SO3·CuSO3·2H2O)是一种深红色固体,不溶于水和乙醇,100℃时发生分解。可由CuSO4·5H2O和SO2等为原料制备,实验装置如下图所示:

(1)装置A在常温下制取SO2时,用较浓的硫酸而不用稀硫酸,其原因是_______________。
(2)装置B中发生反应的离子方程式为_______________。
(3)装置C的作用是____________________。
(4)从B中获得的固体需先用蒸馏水充分洗涤,再真空干燥。
①检验洗涤已完全的方法是__________________。
②不用烘干的方式得到产品,其原因是________________。
(5)请补充完整由工业级氧化铜(含少量FeO)制备实验原料(纯净CuSO4·5H2O)的实验方案:向工业级氧化铜中边搅拌边加入稍过量的硫酸溶液,微热使其完全溶解,_______________,过滤,用95%酒精洗涤晶体2~3次,晾干,得到CuSO4·5H2O。
[已知:①该溶液中氢氧化物开始沉淀与沉淀完全时的pH范围分别为:Fe(OH)2(5.8,8.8);Cu(OH)2(4.2,6.7);Fe(OH)3(1.1,3.2)。②在水溶液中超过100℃,硫酸铜晶体易失去结晶水。③硫酸铜晶体溶解度曲线如右图所示]

查看答案和解析>>
科目: 来源: 题型:
【题目】硫酸铜在生产、生活中应用广泛。某化工厂用含少量铁的废铜渣为原料生产胆矾的流程如下:(已知:Fe3+在PH=3.7时就完全生成氢氧化铁沉淀)

(1)“浸出”时,原料中的铜均转化为硫酸铜。写出相应的化学方程式:________________。
(2)取样检验是为了确认Fe3+是否除尽,你的检验方法是________________
(3)调节pH的目的是____________。从滤液到胆矾应采用_________________过滤。
(4)气体a可以被循环利用,用化学方程式表示其被循环利用的原理为:2NO+O2=2NO2、_________________
(5)在农业上,将胆矾、生石灰和水按一定比例混合制成波尔多液,其反应的化学方程式为___________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】下列离子方程式正确的是( )
A. 碳酸氢铵溶液与少量氢氧化钠溶液:NH![]() +HCO
+HCO![]() +2OH-===NH3·H2O+CO
+2OH-===NH3·H2O+CO![]() +H2O
+H2O
B. 氯化铵溶液中加入少量稀氢氧化钠溶液:NH![]() +OH-===NH3↑+H2O
+OH-===NH3↑+H2O
C. 氨水与盐酸反应:NH3·H2O+H+===NH![]() +H2O
+H2O
D. 氨水中通入过量二氧化碳:2NH3·H2O+CO2===2NH![]() +CO
+CO![]() +H2O
+H2O
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com