
科目: 来源: 题型:
【题目】某研究性学习小组设计了一组实验来探究元素周期律。甲同学设计了如图装置,根据元素非金属性与对应最高价含氧酸之间的关系,可以一次性完成碳族元素中C与Si的非金属性强弱比较的实验研究;乙同学设计了如图装置来验证卤族元素性质的递变规律。A、B、C三处分别是蘸有NaBr溶液的棉花、湿润的淀粉KI试纸、蘸有碱液的棉花。已知常温下浓盐酸与高锰酸钾能反应生成氯气。
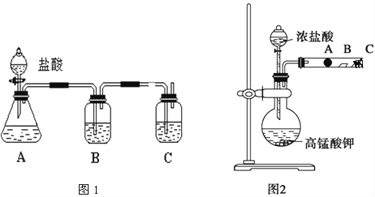
(1)甲同学设计实验的理论依据是_____________________________________;
写出选用药品分别为:A____________,B__________,C____________;
其中装置B中所盛试剂的作用为_____________________________________;
C中反应的离子方程式为____________________________________________;
(2)乙同学的实验理论依据是______________________________________;
A处的现象是: ___________________________________________;
写出B处的离子方程式_____________,C处药品的作用 ____________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】根据水溶液中离子平衡的知识回答下列问题:
I.已知室温时,0.1 mol/L某一元酸HA在水中有0.1%发生电离,则
(1)该溶液中c (H+)=________,HA的电离平衡常数Ka=________;
(2)由HA电离出的c(H+)约为水电离出的c (H+)的________倍。
II.常温下,有A、B、C、D四种无色溶液,它们分别是CH3COONa溶液、NH4Cl溶液、盐酸和NaNO3溶液中的一种。已知A、B的水溶液中水的电离程度相同,A、C溶液的pH相同,则:B是________,C是________。常温下若B溶液中c(OH-)与C溶液中c(H+)相同,B溶液的pH用pHb表示,C溶液的pH用pHc表示,则pHb+pHc=________(填某个数)。
III.将pH=1的稀硫酸慢慢加入一定量的BaCl2溶液中,恰好使Ba2+沉淀完全时溶液的体积为100 mL(混合时溶液体积变化忽略不计),溶液的pH=2,则原BaCl2 溶液中Cl-的浓度为 mol/L。(结果保留两.位.有效数字)
查看答案和解析>>
科目: 来源: 题型:
【题目】在2L容积不变的密闭容器内,800℃时反应2NO(g)+O2(g)![]() 2NO2(g)体系中,n(NO)随时间的变化如下表:
2NO2(g)体系中,n(NO)随时间的变化如下表:

(1)用O2的反应速率表示0~2s内该反应的平均反应速率v=_______________。若上述反应在850℃下进行,反应2s时n(NO)=0.009mol,并且不再随时间而改变,则该反应是__________热反应。
(2)图中表示NO2浓度变化的曲线是__________(填字母)。
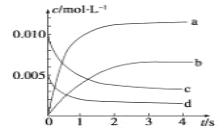
(3)能说明该反应已达到平衡状态的是________(填序号)。
A.v(NO2)=2v(O2) B.容器内的压强保持不变
C.v逆(NO)=2v正(O2) D.容器内气体密度保持不变
(4)能使该反应的反应速率增大,且平衡向正反应方向移动的是________(填序号)。
A.及时分离出NO2 B.适当升高温度
C.增大O2的浓度 D.选择高效催化剂
查看答案和解析>>
科目: 来源: 题型:
【题目】
氢能的存储是氢能应用的主要瓶颈,配位氢化物、富氢载体化合韧是目前所采用的主要储氢材料。
(1)Ti(BH4)2是一种过渡元素硼氢化物储氢材料。在基态Ti中,价电子排布式为____,价电子排布图为____
(2)液氨是富氢物质,是氢能的理想载体,利用N2+3H2![]() 2NH3,实现储氢和输氢。下列说法正确的是_____;
2NH3,实现储氢和输氢。下列说法正确的是_____;
a.NH3分子中氮原子的轨道杂化方式为sp2杂化
b.NH+4与PH+4、CH4、BH-4、ClO—4互为等电子体
c.相同压强时,NH3的沸点比PH3的沸点高
d.[Cu(NH3)4]2+离子中,N原子是配位原子
(3)用价层电子对互斥理论推断SnBr2分子中,Sn原子的轨道杂化方式为__________,
SnBr2分子中 Sn-Br的键角______120°(填“>”“<”或“=”)。
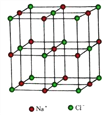
(4) NiO 的晶体结构与氯化钠相同, 在晶胞中镍离子的配位数是_______。
已知晶胞的边长为 a nm, NiO 的摩尔质量为 b g·mol-1, NA为阿伏加德罗常数的值, 则NiO 晶体的密度为_________g·cm-3。
查看答案和解析>>
科目: 来源: 题型:
【题目】【2016江苏卷】根据下列实验操作和现象所得到的结论正确的是
选项 | 实验操作和现象 | 结论 |
A | 室温下,向苯酚钠溶液中通入足量CO2,溶液变浑浊。 | 碳酸的酸性比苯酚的强 |
B | 室温下,向浓度均为0.1 mol·L–1的BaCl2和CaCl2混合溶液中滴加Na2SO4溶液,出现白色沉淀。 | Ksp(BaSO4)<Ksp(CaSO4) |
C | 室温下,向FeCl3溶液中滴加少量KI溶液,再滴加几滴淀粉溶液,溶液变蓝色。 | Fe3+的氧化性比I2的强 |
D | 室温下,用pH试纸测得:0.1mol·L–1 Na2SO3溶液的pH约为10;0.1mol·L–1 NaHSO3溶液的pH约为5。 | HSO3–结合H+的能力比 SO32–的强 |
查看答案和解析>>
科目: 来源: 题型:
【题目】在恒温恒容容器中.可逆反应2NO(g)+O2(g)![]() 2NO2(g)△H<0,不能说明已达到平衡状态的是
2NO2(g)△H<0,不能说明已达到平衡状态的是
A. O2的消耗速率和NO2的生成速率之比为l:2
B. 反应容器中压强不随时间变化而变化
C. 混合气体颜色深浅保持不变
D. 混合气体平均分子量保持不变
查看答案和解析>>
科目: 来源: 题型:
【题目】下图是中学教材中元素周期表的一部分,其中标出A-Q14种元素,试回答下列问题:[(1) (2)问用具体的元素符号或离子符号或化学式回答]
A | B | C | D | ||||||||||||||
E | F | G | H | I | J | K | L | ||||||||||
P | Q |
(1)在上表所列出的短周期元素中
①性质最不活泼的是_______;②原子半径最大的是_____(除稀有气体元素)
③形成的气态氢化物最稳定的是_______;
④最高价氧化物对应的水化物中酸性最强的是_______碱性最强的是_______。
⑤形成的阴离子还原性最弱的是_______,阳离子半径最小的是_______。
(2)用电子式表示F与D形成化合物的过程
________________________________________________________________________;
(3)设P的原子序数为Z,则F的原子序数为___________,Q的原子序数为____________。
查看答案和解析>>
科目: 来源: 题型:
【题目】新型高效的甲烷燃料电池采用铂为电极材料,两电极上分别通入CH4和O2,电解质为KOH溶液。某研究小组将两个甲烷燃料电池串联后作为电源,进行饱和氯化钠溶液电解实验,如图所示。
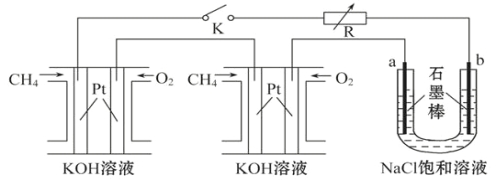
回答下列问题:
(1)甲烷燃料电池正极的电极反应为________________、负极的电极反应____________。
(2)闭合K开关后,a、b电极上均有气体产生,其中b电极上得到的是____________,电解氯化钠溶液的总反应方程式为____________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】短周期元素W、X、Y、Z的原子序数依次增加。m、p、r是由这些元素组成的二元化合物,n是元素Z的单质,通常为黄绿色气体,q的水溶液具有漂白性, r溶液是一种常见的强酸,s通常是难溶于水的混合物。上述物质的转化关系如图所示。下列说法正确的是
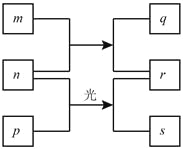
A. 原子半径的大小W<X<Y
B. 元素的非金属性Z>X>Y
C. Y的氢化物常温常压下为液态
D. X的最高价氧化物的水化物为强酸
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com