
科目: 来源: 题型:
【题目】七铝十二钙(12CaO·7Al2O3)是新型的超导材料和发光材料,用白云石(主要含CaCO3和MgCO3)和废Al片制备七铝十二钙的工艺如下:
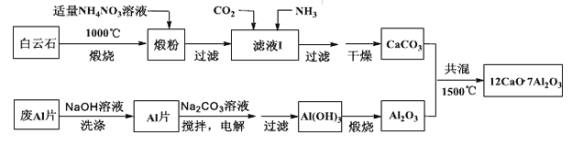
(1)煅粉主要含MgO和 ,用适量的NH4NO3溶液浸取煅粉后,镁化合物几乎不溶, 若溶液I中c(Mg2+)小于5×10-6mol·L-1,则溶液pH大于 (Mg(OH)2的Ksp=5×10-12);该工艺中不能用(NH4)2SO4代替NH4NO3,原因是 。
(2)滤液I中的阴离子有 (忽略杂质成分的影响);若滤液I中仅通入CO2,会生成 ,从而导致CaCO3产率降低。
(3)用NaOH溶液可除去废Al片表面的氧化膜,反应的离子方程式为 。
(4)电解制备Al(OH)3时,电极分别为Al片和石墨,电解总反应方程式为 。
(5)一种可超快充电的新型铝电池,充放电时AlCl4—和Al2Cl7—两种离子在Al电极上相互转化,其它离子不参与电极反应,放电时负极Al的电极反应式为 。
查看答案和解析>>
科目: 来源: 题型:
【题目】水中溶氧量(DO)是衡量水体自净能力的一个指标,通常用每升水中溶解氧分子的质量表示,单位mg/L,我国《地表水环境质量标准》规定,生活饮用水源的DO不能低于5mg/L。某化学小组同学设计了下列装置(夹持装置略),测定某河水的DO。
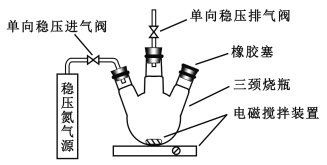
Ⅰ.测定原理:
碱性条件下,O2将Mn2+氧化为MnO(OH)2:①2Mn2++O2+4OH=2 MnO(OH)2↓
酸性条件下,MnO(OH)2将I氧化为I2:②MnO(OH)2+I+H+→Mn2++I2+H2O(未配平),用Na2S2O3标准溶液滴定生成的I2:③2S2O32+I2=S4O62+2I
Ⅱ. 测定步骤
a.安装装置,检验气密性,充N2排尽空气后,停止充N2。
b.向烧瓶中加入200 mL水样。
c.向烧瓶中依次迅速加入1 mL MnSO4无氧溶液(过量)、2mL碱性KI无氧溶液(过量),开启搅拌器,至反应①完全。
d搅拌并向烧瓶中加入2 mL硫酸无氧溶液至反应②完全,溶液为中性或弱酸性。
e.从烧瓶中取出40.00 mL溶液,以淀粉作指示剂,用0.01000 mol/L Na2S2O3溶液进行滴定,记录数据。
f.……
g.处理数据(忽略氧气从水样中的逸出量和加入试剂后水样体积的变化)。
回答下列问题:
(1)配置以上无氧溶液时,除去所用溶剂水中氧的简单操作为__________。
(2)在橡胶塞处加入水样及有关试剂应选择的仪器为__________。
①滴定管②注射器③量筒
(3)搅拌的作用是__________。
(4)配平反应②的方程式,其化学计量数依次为__________。
(5)步骤f为__________。
(6)步骤e中达到滴定终点的标志为__________。若某次滴定消耗Na2S2O3溶液4.50mL,水样的DO=__________mg/L(保留一位小数)。作为饮用水源,此次测得DO是否达标:__________(填“是”或“否”)
(7)步骤d中加入硫酸溶液反应后,若溶液pH过低,滴定时会产生明显的误差,写出产生此误差的原因(用离子方程式表示,至少写出2个)__________。
查看答案和解析>>
科目: 来源: 题型:
【题目】设NA表示阿伏伽德罗常数的值。下列说法正确的是( )
A. 向含有FeI2的溶液中通入适量氯气,当有1molFe2+被氧化时,该反应转移电子数目为3NA
B. 40gCuO和Cu2S混合物中所含铜原子的数目不等于0.5 NA
C. 含0.1molNH4HSO4的溶液中,阳离子数目略小于0.2NA
D. C3H8分子中的2个H原子分别被1个-NH2和1个-OH取代,1mol此有机物所含共用电子对数目为13NA
查看答案和解析>>
科目: 来源: 题型:
【题目】氢氧燃料电池是符合绿色化学理念的新型发电装置。如图为该电池的工作原理示意图,该电池的电极表面镀一层细小的铂粉,吸附气体的能力强,性质稳定。请回答:
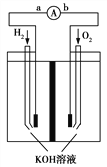
(1)氢氧燃料电池放电时能量转化形式主要是________,
在导线中电子流动方向为________(用a.b表示)。
(2)负极反应式为__________________。
(3)电极表面镀铂粉的原因为__________________。
(4)该电池工作时,H2和O2连续由外部供给,电池可连续不断提供电能。因此,大量安全储氢是关键技术之一,金属锂是一种重要的储氢材料,吸氢和放氢原理如下:
Ⅰ.Li+H2![]() 2LiH Ⅱ.LiH+H2O===LiOH+H2↑
2LiH Ⅱ.LiH+H2O===LiOH+H2↑
①反应Ⅰ中的还原剂是________,反应Ⅱ中的氧化剂是____________。
②知LiH固体的密度为0.82 g/cm3。用锂吸收224 L(标准状况)H2,生成的LiH体积与被吸收的H2体积比为________。
③将由②生成的LiH与H2O作用放出的H2用作电池燃料,若能量转化率为80%,则导线中通过电子的物质的量为________mol。
查看答案和解析>>
科目: 来源: 题型:
【题目】已知反应AsO43-+2I-+2H+![]() AsO33-+I2+H2O是可逆反应。设计如图装置(C1、C2均为石墨电极),分别进行下述操作。
AsO33-+I2+H2O是可逆反应。设计如图装置(C1、C2均为石墨电极),分别进行下述操作。
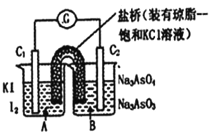
Ⅰ.向B烧杯中逐滴加入浓盐酸
Ⅱ.向B烧杯中逐滴加入40% NaOH溶液
结果发现电流计指针均发生偏转.据此,下列判断正确的是
A.Ⅰ操作过程中,C2棒上发生的反应为:AsO43-+2H++2e-=AsO33-+H2O
B.操作Ⅱ过程中,盐桥中的K+移向B烧杯溶液
C.操作Ⅰ过程中,C1为正极
D.Ⅱ操作过程中,C1棒上发生的反应为:2I-_2e-=I2
查看答案和解析>>
科目: 来源: 题型:
【题目】I.炒过菜的铁锅为及时洗净,不久便会因腐蚀而出现红褐色锈斑。请回答:
(1)铁锅的锈蚀是 腐蚀(填“析氢“或“吸氧”)。
(2)写出铁锅腐蚀时正极的电极反应式: 。
II.①某同学用碳棒、铜棒和稀硫酸为原材料,实现了在通常条件下不能发生的反应:Cu+H2SO4(稀)=CuSO4+H2↑。请画出能够实验这一反应的装置图。
②某同学在做一定条件下铜与稀硫酸的反应实验时,看到碳棒上有气泡产生,但铜棒却没有被腐蚀。请你分析其原因:
查看答案和解析>>
科目: 来源: 题型:
【题目】H3BO3可以通过电解NaB(OH)4溶液的方法制备,其工作原理如图,下列叙述错误的是( )

A. M室发生的电极反应式为:2H2O-4e- = O2↑+4H+
B. N室中:a% <b%
C. b膜为阴膜,产品室发生反应的化学原理为强酸制弱酸
D. 理论上每生成1mol产品,阴极室可生成标准状况下5.6L气体
查看答案和解析>>
科目: 来源: 题型:
【题目】镁及其化合物一般无毒(或低毒)、无污染,且镁原电池放电时电压高而平衡,使镁原电池越来越成为人们研制绿色原电池的关注焦点。其中一种镁原电池的反应为xMg+Mo3S4![]() MgxMo3S4;在镁原电池放电时,下列说法错误的是 ( )
MgxMo3S4;在镁原电池放电时,下列说法错误的是 ( )
A.Mg2+向正极迁移
B.正极反应为:Mo3S4+2xe-===Mo3S![]()
C.Mo3S4发生氧化反应
D.负极反应为:xMg-2xe-===xMg2+
查看答案和解析>>
科目: 来源: 题型:
【题目】下列说法不正确的是 ( )
A. 催化剂能够改变化学反应路径 B. 升高温度提高了活化分子百分数
C. 增大反应物浓度提高了活化分子百分数 D. 增大压强能增大活化分子的浓度
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com