
科目: 来源: 题型:
【题目】下列说法正确的是
A.π键是由两个p轨道“头碰头”重叠形成的
B.σ键就是单键,π键就是双键
C.乙烷分子中的键全为σ键,而乙烯分子中含σ键和π键
D.H2分子中含σ键,而Cl2分子中含π键
查看答案和解析>>
科目: 来源: 题型:
【题目】“在2支大小相同的试管中各装入2~3 mL约5%的H2O2溶液,再向其中1支试管中滴入1~2滴1 mol/L FeCl3溶液,对比观察现象。”
Ⅰ.体验H2O2分解的实验意义
(1)指出本实验的探究目的:________。
(2)写出H2O2分解反应方程式并标出电子转移的方向和数目:________。
(3)在盛有滴入FeCl3溶液的H2O2溶液中,可观察到溶液中 ________ ;溶液温度升高;溶液由浅黄色变成棕黄色,最后恢复为浅黄色。
Ⅱ.探讨FeCl3催化H2O2分解的机理
(4)Fe3+催化H2O2分解时涉及2步反应:
第1步,Fe3+氧化H2O2:2Fe3++H2O2═2Fe2++O2↑+2H+
第2步,H2O2氧化Fe2+:________(用离子方程式表示)
查看答案和解析>>
科目: 来源: 题型:
【题目】下列关于热化学反应的描述中正确的是( )
A.HCl和NaOH反应的中和热ΔH=-57.3 kJ/mol,则H2SO4和Ca(OH)2反应的反应热ΔH=2×(-57.3) kJ/mol
B.CO(g)的燃烧热是283.0 kJ/mol,则2CO2(g)===2CO(g)+O2(g)反应的ΔH=+566.0 kJ/mol
C.需要加热才能发生的反应一定是吸热反应
D.1 mol甲烷燃烧生成气态水和二氧化碳所放出的热量是甲烷的燃烧热
查看答案和解析>>
科目: 来源: 题型:
【题目】下列关于各图像的解释或结论正确的是( )
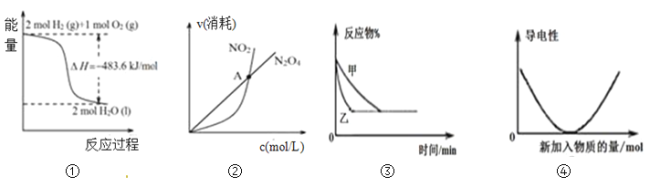
A.图①可知:热化学方程式是H2(g)+1/2O2(g)=H2O(g)△H=﹣241.8kJ/mol
B.图②可知:对于恒温恒容条件下的反应2NO2(g)![]() N2O4(g),A点为平衡状态
N2O4(g),A点为平衡状态
C.图③可表示:压强对2A(g)+2B(g)![]() 3C(g)+D(s)的影响
3C(g)+D(s)的影响
D.图④可表示:Ba(OH)2溶液中滴加稀硫酸,溶液导电性的变化
查看答案和解析>>
科目: 来源: 题型:
【题目】室温下,将1 mol的CuSO4·5H2O(s)溶于水会使溶液温度降低,热效应为ΔH1,将1 mol的CuSO4(s)溶于水会使溶液温度升高,热效应为ΔH2;CuSO4·5H2O受热分解的化学方程式为CuSO4·5H2O(s)![]() CuSO4(s)+5H2O(l),热效应为ΔH3。则下列判断正确的是
CuSO4(s)+5H2O(l),热效应为ΔH3。则下列判断正确的是
A.ΔH2>ΔH3 B.ΔH1<ΔH3 C.ΔH1+ΔH3=ΔH2 D.ΔH1+ΔH2=ΔH3
查看答案和解析>>
科目: 来源: 题型:
【题目】利用含碳化合物合成新燃料是发展低碳经济的重要方法,已知CO(g)+2H2(g) ![]() CH3OH(g)过程能量情况如下图所示,曲线Ⅰ和曲线Ⅱ分别表示不使用催化剂和使用催化剂的两种情况。下列判断正确的是( )
CH3OH(g)过程能量情况如下图所示,曲线Ⅰ和曲线Ⅱ分别表示不使用催化剂和使用催化剂的两种情况。下列判断正确的是( )

A.该反应的ΔH=+91 kJ·mol-1
B.加入催化剂,该反应的ΔH变小
C.反应物的总能量大于生成物的总能量
D.如果该反应生成液态CH3OH,则ΔH增大
查看答案和解析>>
科目: 来源: 题型:
【题目】下列说法正确的是
A. 相同体积、相同浓度的氨水和NaOH溶液中和盐酸的能力相同
B. 醋酸溶液中只存在一个电离平衡体系
C. 0.1mol · L-1的氨水能使酚酞试液变红,说明氨水是弱电解质水溶液
D. 同浓度同体积的醋酸和盐酸分别与足量镁反应时,放出H2的速率相同
查看答案和解析>>
科目: 来源: 题型:
【题目】已知X、Y、Z、W是短周期中原子序数依次增大的4种主族元素。X元素原子的最外层未达到8电子稳定结构,工业上通过分离液态空气获得其单质;元素Y 的原子最外层电子数是其内层的3倍;Z元素+2价阳离子的核外电子排布与氖原子相同;W的单质常温常压下为气态。
回答下列问题:
(1)元素W在周期表中位于第 ________ 周期,第 ________ 族。
(2)从空气中获得的X元素单质的电子式: ________ 。
(3)比较Y与Z形成的简单(单原子)离子的半径相对大小:________﹤ (用离子符号表示)。
(4)管道工人曾经用X的氢化物检验W单质是否泄漏。W单质能将X从其气态氢化物中置换出来。试写出该反应的化学方程式: ________ ;W单质泄漏时出现的现象是 ________ 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com