
科目: 来源: 题型:
【题目】有A、B、C、D四种强电解质,它们在水中电离产生下列离子(每种物质只含一种阴离子且互不重复)。
阳离子 | Na+、Ba2+、NH |
阴离子 | CH3COO-、OH-、Cl-、SO |
已知:①A、C溶液的pH均大于7,A、B的溶液中水的电离程度相同;②C溶液和D溶液相遇时只生成白色沉淀,B溶液和C溶液相遇时只生成刺激性气味的气体,A溶液和D溶液混合时无现象。
(1)A是_____________,B是____________(填化学式) 。用离子方程式表示A的水溶液中存在的平衡关系: 。
(2)25 ℃时,0.1 mol·L-1 B溶液的pH=a,则B溶液中:c(H+)-c(OH—)=_____________(填微粒浓度符号)=_____________(用含有a的关系式表示)。
(3)将等体积、等物质的量浓度的B溶液和C溶液混合,反应后溶液中各种离子浓度由大到小的顺序是_____________。
(4)在一定体积的0.005 mol·L-1的C溶液中,加入一定体积的0.00125 mol·L-1的盐酸,混合溶液的pH=11,若反应后溶液的体积等于C溶液与盐酸的体积之和,则C溶液与盐酸的体积比是_ _____。
(5)在化学分析中采用K2CrO4为指示剂,以AgNO3标准溶液滴定溶液中Cl,利用Ag+与CrO42生成砖红色沉淀,指示到达滴定终点。当溶液中Cl恰好沉淀完全(浓度等于1.0×105 mol·L1)时,溶液中c(Ag+)为_______ mol·L1,此时溶液中c(CrO42)等于__________ mol·L1。(已知Ag2CrO4、AgCl的Ksp分别为2.0×1012和2.0×1010)。
(6)现使用酸碱中和滴定法测定酸的浓度。在本实验的滴定过程中,下列操作会使实验结果偏大的是 (填写序号)。
a.碱式滴定管在滴定时未用标准NaOH溶液润洗
b.碱式滴定管的尖嘴在滴定前有气泡,滴定后气泡消失
c.锥形瓶中加入待测酸溶液后,再加少量水
d.锥形瓶在滴定时剧烈摇动,有少量液体溅出
查看答案和解析>>
科目: 来源: 题型:
【题目】宋代著名法医学家宋慈的《洗冤集录》中有一“银针验毒”的记载,“银针验毒”的原理是4Ag+2H2S+O2 =2Ag2S+2H2O。该反应中H2S是
A. 氧化剂
B. 还原剂
C. 既是氧化剂又是还原剂
D. 既不是氧化剂又不是还原剂
查看答案和解析>>
科目: 来源: 题型:
【题目】现有下列物质:维生素A、维生素C、碘元素、铁元素、淀粉、油脂。请选择正确答案填在相应的空格里。
①人体缺乏某种维生素会引起坏血病,这种维生素是__________。
②人体缺乏某种微量元素会发生贫血,这种微量元素是__________。
③既能为人体提供热量,又能提供必需脂肪酸的物质是__________。
查看答案和解析>>
科目: 来源: 题型:
【题目】已知2H(g)+Y(g)![]() 2I(g)反应,在t℃时,在一压强恒定的密闭容器中,加入4 mol H和2 mol Y反应,达到平衡后,Y剩余0.2 mol。若在上面的平衡体系中,再加入1 mol气态的I物质,t ℃时达到新的平衡,此时H物质的物质的量n(H)为( )
2I(g)反应,在t℃时,在一压强恒定的密闭容器中,加入4 mol H和2 mol Y反应,达到平衡后,Y剩余0.2 mol。若在上面的平衡体系中,再加入1 mol气态的I物质,t ℃时达到新的平衡,此时H物质的物质的量n(H)为( )
A.0.2mol B.0.5 mol C.0.6 mol D.0.8 mol
查看答案和解析>>
科目: 来源: 题型:
【题目】下表是元素周期表的一部分,①~⑩代表某元素,请回答以下问题:
主族 周期 | IA | IIA | IIIA | IVA | VA | VIA | VIIA | 0 |
二 | ① | ② | ③ | |||||
三 | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ | ||
四 | ⑩ |
(1)在①~⑩中,化学性质最不活泼的元素其原子结构示意图为___________;
(2)在①~⑩中,金属性最强的元素是_________(填元素符号),在化合物中均只显负价的元素是__________(填元素符号);
(3)在④~⑧中,元素的最高价氧化物对应的水化物中酸性最强的是__________(填物质化学式,下同),碱性最强的是________;
(4)在④~⑧中,原子半径最小的是__________(填元素符号),简单离子半径最小的是_______(填离子符号);
(5)在①、③、⑦、⑧元素的气态氢化物中最稳定的是__________(填氢化物化学式);
(6)写出工业上用①单质在高温条件制取⑦单质的化学方程式______________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】某科学家利用二氧化铈(CeO2)在太阳能作用下将H2O、CO2转变为H2、CO。其过程如下:
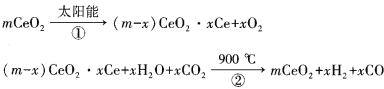
下列说法不正确的是( )
A.该过程中CeO2没有消耗
B.该过程实现了太阳能向化学能的转化
C.以CO和O2构成的碱性燃料电池的负极反应式为CO+4OH——2e—= CO32—+2H2O
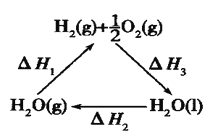
D.上图中△H1=△H2+△H3
查看答案和解析>>
科目: 来源: 题型:
【题目】(1)Zn粒和稀盐酸反应一段时间后,反应速率会减慢,当加热或加入浓盐酸后,反应速率明显加快。由此判断,影响化学反应速率的因素有______和______。
(2)锌与盐酸反应速率可以通过观察_________进行判断,也可通过实验测定。通过实验测定锌与盐酸反应速率,除测量反应时间外,还需要测量的物理量是_______或 _____。
(3)为探究锌与盐酸反应过程的速率变化,某同学的实验测定方法是:在100ml稀盐酸中加入足量的锌粉,用排水集气法收集反应放出的氢气,实验记录如下(氢气体积已换算为标准状况):
时间/min | 1 | 2 | 3 | 4 | 5 |
体积/mL | 50 | 120 | 232 | 290 | 310 |
①哪一时间段反应速率最大_______(填“0~1 min”或“1~2 min”或“2~3 min”或“3~4 min”或“4~5min”)。
②2~3 min时间段以盐酸的浓度变化来表示的该反应速率(设溶液体积不变)为____________。
③试分析1~3min时间段里,反应速率变大的主要原因_________________________ 。
查看答案和解析>>
科目: 来源: 题型:
【题目】已知五种短周期元素,A、B、C、D、E的核电荷数依次增大,其中B、E同主族,A元素的氢化物是被称为高效、较纯净的燃料;B元素是地壳中含量最多的元素;C、D、E三种原子的最外电子层电子数之和为10,且这三种元素的最高氧化物对应水化物之间两两皆能反应,均生成盐和水。
(1)推断A、B、C、D、E五种元素,写出下列元素名称:
B:________ C:________ E:_________
(2)C2E化合物名称为_____________;
(3)写出化合物AB2的电子式_____________
(4)写出D的单质与E的最高价氧化物的水化物的稀溶液反应的离子方程式为
_____________________________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】在一定条件下,密闭容器中可发生可逆反应:N2(g) + 3H2(g) ![]() 2NH3(g) 。下列说法中,表明这一反应已经达到化学平衡状态的是
2NH3(g) 。下列说法中,表明这一反应已经达到化学平衡状态的是
A. N2、H2、NH3的浓度相等 B. N2、H2、NH3的浓度不再变化
C. N2、H2、NH3在密闭容器中共存 D. 反应停止,正、逆反应速率都等于零
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com