
科目: 来源: 题型:
【题目】含氮化合物在生产、生活和科研中有着广泛的应用。
(1)工业上采用NH3为还原剂处理烟气(假设烟气中的NO和NO2的物质的量相等,且反应产物为无毒气体),测量逸出气体中氮氧化物含量,从而确定烟气脱氮率。如图,下列列说法正确的是(填写下列字母编号)

a.相同条件下,改变压强对脱氮率有影响
b.曲线最高点表示此时平衡转化率最高
c.相同条件下,加入不同的催化剂能够改变反应物的转化率
d.上述反应的化学方程式为:NO+NO2+2NH3![]() 2N2
2N2![]() 3H2O
3H2O
(2)已知: 2NH3(g)+CO2(g)![]() CO(NH2)2(s)+H2O(g) △H=-43.0KJ·mol-1
CO(NH2)2(s)+H2O(g) △H=-43.0KJ·mol-1
—定条件下,将2molNH3和1molCO2充入容积为2L的密闭容器中发生反应。反应进行2min时,放出热量21.5kJ,则2min内该反应的反应速率υ(NH3)= ,此时混合气体中NH3的体积分数为 。
(3)在25℃下,将a molL-1的NH4NO3溶液与0.01molL-1的NaOH等体积混合,反应平衡时,测得溶液pH=7,则NH4NO3溶液的物质的量浓度a___________0.01molL-1(填“>”、“<”或“=”);滴加NaOH的过程中水的电离平衡将 (填“正向”、“不”或“逆向”)移动。请你设计实验,比较NH3 H2O的电离程度和NH4NO3的水解程度大小 。
查看答案和解析>>
科目: 来源: 题型:
【题目】碱式碳酸铜(Cu2(OH)2CO3)是名贵的矿物宝石孔雀石的主要成分,应用广泛,如在无机工业中用于制造各种铜化合物,有机工业中用作有机合成催化剂等等,某化学小组为了探究碱式碳酸铜生成条件对其产率的影响,设计了如下实验:
设计原理:取一定体积的碳酸钠溶液(0.5mol/L)于100mL烧杯中,进行加热,恒温后将硫酸铜溶液(5.00mL,0.5mol/L)在不断搅拌下以一定速度逐滴加入到上述碳酸钠溶液中,反应达平衡后,静止,减压过滤,洗涤,烘干,即得到最终产品,同时有气体放出。
(1)反应原理为:________________________________ 。
(2)探究反应原料用量比对反应产物的影响。
该化学小组根据所提供试剂设计两个实验,来说明反应原料用量对产品的影响。
提供试剂:0.5mol/LNa2CO3溶液、0.5mol/L CuSO4溶液
①填写下表的空白处:_____________、_____________。

②通过实验画图可知:当比值为_____________ ,碱式碳酸铜产量最好。

(3)反应温度对产率的影响
在三支试管中各加入2.0 mL 0.5 mol·L-1CuSO4溶液,另取四支试管各加入由上述实验得到的合适用量的0.5 mol·L-1 Na2CO3溶液。从这两列试管中各取一支将它们分别置于室温、30℃、50℃、100℃的环境中,数分钟后将CuSO4溶液倒入Na2CO3溶液中振荡并观察现象,发现:沉淀颜色分别为蓝色沉淀,绿色沉淀,深绿色沉淀,绿色中带有黑色沉淀,实验结果也如上图所示,请思考,为什么温度过高产率反而下降________________,该实验加热方式为_______________________。
(4)分析所制得的碱式碳酸铜的质量分数。
将已准确称量的0.5g试样放入300mL的锥形瓶中,加入5mL醋酸加热使其溶解,再用100mL水将其稀释。加入2.5gKI振荡混合,经过5分钟后,加入数滴淀粉溶液,用0.1mol/L的硫代硫酸钠溶液进行滴定。当_____________________ 时即达滴定的终点。
(5)反应的原理:2Cu2+ + 4I— == 2CuI + I2 ,I2+2 S2O32— == 2 I—+ S2O6 2—。 若消耗0.1mol/L硫代硫酸钠40 mL,则试样中铜的质量百分率为________________ 。
该溶液的滴定度为______________。(每毫升标准溶液相当于被测物质的质量,单位是g/mL或mg/mL)(保留三位有效数字)
查看答案和解析>>
科目: 来源: 题型:
【题目】某温度下,在固定容积的密闭容器中,可逆反应A(g)+3B(g)![]() 2C(g)达到平衡时,各物质的物质的量之比为n(A)∶n(B)∶n(C)=2∶2∶1。保持温度不变,以2∶2∶1的物质的量之比再充入A、B、C,则:
2C(g)达到平衡时,各物质的物质的量之比为n(A)∶n(B)∶n(C)=2∶2∶1。保持温度不变,以2∶2∶1的物质的量之比再充入A、B、C,则:
A.平衡不移动
B.再达平衡时,n(A)∶n(B)∶n(C)仍为2∶2∶1
C.再达平衡时,C的体积分数增大
D.再达平衡时,正反应速率增大,逆反应速率减小
查看答案和解析>>
科目: 来源: 题型:
【题目】醋酸溶液中存在电离平衡CH3COOH![]() H++CH3COO-,下列叙述不正确的是
H++CH3COO-,下列叙述不正确的是
A. 升高温度,平衡正向移动,醋酸的电离常数Ka值增大
B. 0.l0mol/L的CH3COOH溶液中加水稀释,溶液中c(OH-)增大
C. CH3COOH溶液中加少量的CH3COONa固体,平衡逆向移动
D. 室温下,欲使0.1mol/L醋酸溶液的pH,电离度a都减小,可加入少量水
查看答案和解析>>
科目: 来源: 题型:
【题目】有甲、乙两位同学,他们一起做了如图所示的水果电池实验,测得数据如下表:
实验次数 | 电极材料 | 水果品种 | 电极间距/cm | 电压/mV | |
1 | 锌 | 铜 | 菠萝 | 3 | 900 |
2 | 锌 | 铜 | 苹果 | 3 | 650 |
3 | 锌 | 铜 | 柑橘 | 3 | 850 |
4 | 锌 | 铜 | 西红柿 | 3 | 750 |
5 | 锌 | 铝 | 菠萝 | 3 | 650 |
6 | 锌 | 铝 | 苹果 | 3 | 450 |
甲同学提出的问题,乙同学解释不正确的是
①甲:实验6中的负极反应如何写? 乙:铝为负极:Al-3e-===Al3+
②甲:实验1、5电流方向为什么相反? 乙:实验1中锌为负极,电流由铜经导线流向锌;实验5中铝为负极,铝失去电子,电流由锌经导线流向铝
③甲:水果电池的电压与哪些因素有关? 乙:只跟水果的品种有关。
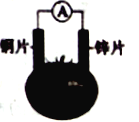
A. ③ B. ① C. ①②③ D. ②③
查看答案和解析>>
科目: 来源: 题型:
【题目】在某温度时,将n mol·L-1氨水滴入10mL 1.0mol·L-1盐酸中,溶液pH和温度随加入氨水体积变化曲线如图所示。下列有关说法正确的是:
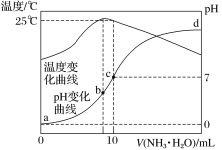
A.a点Kw=1.0×10-14
B.水的电离程度:c > b >a>d
C.b点:c(NH![]() )>c(Cl-)>c(H+)>c(OH-)
)>c(Cl-)>c(H+)>c(OH-)
D.25℃时,NH4Cl水解常数Kh= ![]() mol·L-1 (用含n的代数式表示)
mol·L-1 (用含n的代数式表示)
查看答案和解析>>
科目: 来源: 题型:
【题目】下列关于反应热的描述中正确的是
A. HCl和NaOH反应的中和热△H=-57.3kJ/mol,则H2SO4和Ba(OH)2反应生成1molH2O时会放出57.3kJ的热量
B. 由C(石墨,s)——C(金刚石,s)△H=+1.9 kJmol-1可知,石墨比金刚石更稳定
C. 在500℃、MPa下,将0.5 mol N2和l.5 mol H2置于密闭容器中充分反应生成NH3,放热19.3kJ,则其热化学方程式为:N2(g)+3H2(g)![]() 2NH3(g) △H=-38.6 kJmol-1
2NH3(g) △H=-38.6 kJmol-1
D. 甲烷的燃烧热(△H)为-890.3 kJmol-1,则甲烷燃烧的热化学方程式可表示为CH4(g)+2O2(g)![]() CO2(g)+2H2O(g) △H=-890.3 kJmol-1
CO2(g)+2H2O(g) △H=-890.3 kJmol-1
查看答案和解析>>
科目: 来源: 题型:
【题目】常温下,根据表中的几种物质的电离平衡常数回答下列问题:
NH3·H2O | 2×10-5 |
HNO2 | 7×10-4 |
HClO | 3×10-8 |
H2CO3 | K1=4×10-7 K2=4×10-11 |
(1)常温下,等浓度的NH4NO3和NH4NO2两份溶液,测得NH4NO2溶液中c(NH![]() )较小,试分析原因: 。0.1mol·L-1NH4NO2溶液中离子浓度由大到小的顺序是 ,NO
)较小,试分析原因: 。0.1mol·L-1NH4NO2溶液中离子浓度由大到小的顺序是 ,NO![]() 水解反应的平衡常数Kh= mol·L-1(保留两位有效数字)。
水解反应的平衡常数Kh= mol·L-1(保留两位有效数字)。
(2)常温下,用氨水吸收CO2得到NH4HCO3溶液,其pH 7 (填“>”、“<”或“=”);反应NH3·H2O+H2CO3![]() NH
NH![]() +HCO
+HCO![]() +H2O的平衡常数K= 。
+H2O的平衡常数K= 。
(3) 少量CO2通入到过量的NaClO溶液中发生反应的离子方程式 :
查看答案和解析>>
科目: 来源: 题型:
【题目】某酸件废水可能含有Fe2+、Fe3+、Al3+、Mg2+、Na+、K+、CO32-、SO42-。取废水祥品分别进行如图所示①~④四个实验。下列推断正确的是

A. 废水含有Na+,不含K+
B. 废水含有SO42-和CO32-
C. 废水不含Fe3+,可能含Fe2+
D. 废水一定含有Na+、Al3+、SO42-
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com