
科目: 来源: 题型:
【题目】铜、锌、稀硫酸、导线可组成原电池,则负极上发生的反应是
A. Cu-2e-=Cu2+ B. Zn-2e-=Zn2+ C. 2H2O+O2+4e-=4OH- D. 2H++2e-=H2
查看答案和解析>>
科目: 来源: 题型:
【题目】0.5 L 1 mol/L FeCl3溶液与0.2 L 1 mol/L KCl溶液中的Cl-的物质的量浓度之比( )
A.5:2 B. 3:1 C.15:2 D. 1:3
查看答案和解析>>
科目: 来源: 题型:
【题目】对于敞口容器中的化学反应:Zn(s)+H2SO4(aq)===ZnSO4(aq)+H2(g),下列叙述中不正确的是( )

A. Zn和H2SO4的总能量大于ZnSO4和H2的总能量
B. 反应过程中能量关系可用上图表示
C. 若将该反应设计成原电池,则Zn为负极
D. 若将该反应设计成原电池,当有32.5g锌溶解时正极放出11.2 L气体
查看答案和解析>>
科目: 来源: 题型:
【题目】常温下,0.1 mol·L-1的某一元酸(HA)溶液中![]() =1×10-8,下列叙述正确的是
=1×10-8,下列叙述正确的是
A.该一元酸溶液的pH=1
B.该溶液中水电离出的c(H+)=1×10-11molL-1
C.该溶液中水的离子积常数为1×1022
D.用 pH=11的NaOH 溶液 V1 L 与V2 L 0.1 mol·L-1该一元酸(HA)溶液混合,若混合溶液的pH=7,则V1<V2
查看答案和解析>>
科目: 来源: 题型:
【题目】硫酸锌可用于制造锌钡白、印染媒染剂等。用锌白矿(主要成分为ZnO,还含有Fe2O3、CuO、SiO2等杂成) 制备ZnSO4 ·7H2O的流程如下。
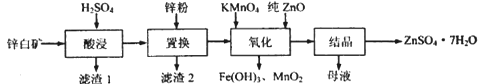
相关金属离了生成氢氧化物沉淀的pH (开始沉淀的pH按金属离子浓度为1.0mol·L-1计算)如下表:
金属离子 | 开始沉淀的pH | 沉淀完全的pH |
Fe3+ | 1.1 | 3.2 |
Fe2+ | 5.8 | 8.8 |
Zn2+ | 6.4 | 8.0 |
(1)“滤渣1”的主要成分为_________(填化学式)。“酸浸”过程中,提高锌元素浸出率的措施有:适当提高酸的浓度、______________(填一种)。
(2)“置换”过程中,加入适量的锌粉,除与溶液中的Fe3+,H+反应外,另一主要反应的化学方程式为__________________________。
(3)“氧化”一步中,发生反应的离子方程式为_______________________。溶液pH控制在[3.2,6.4)之间的目的是________________。
(4)“母液”中含有的盐类物质有_________ (填化学式)。
查看答案和解析>>
科目: 来源: 题型:
【题目】某温度下,相同体积相同pH的盐酸和醋酸分别加水稀释,pH随溶液体积变化的曲线如图所示。下列判断正确的是

A.Ⅱ为盐酸稀释时的pH值变化曲线
B.b点溶液的导电性比c点溶液的导电性强
C.a点KW的数值比c点KW的数值大
D.b点酸的总浓度大于a点酸的总浓度
查看答案和解析>>
科目: 来源: 题型:
【题目】对于常温下pH=2的醋酸溶液,下列叙述正确的是
A.c(H+)=c(CH3COO-)
B.加水稀释时![]() 增大
增大
C.与pH = 12的NaOH溶液等体积混合后,溶液呈中性
D.加入醋酸钠固体可抑制醋酸的电离,电离常数Ka变小
查看答案和解析>>
科目: 来源: 题型:
【题目】Ⅰ.(1)已知NaHA水溶液呈碱性。
①用离子方程式及文字表示NaHA水溶液呈碱性的原因__________________。
②在NaHA水溶液中各离子浓度的大小关系是______________。
(2)25℃时,向浓度均为0.1mol·L-1的MgCl2和CuCl2混合溶液中逐滴加入氨水,先生成__________沉淀(填化学式),生成该沉淀的离子方程式为__________________。已知25℃时Ksp[Mg(OH)2]=1.8×10-11,Ksp[Cu(OH)2]=2.2×10-20。
Ⅱ.(5分)已知二元酸H2A在水中存在以下电离:H2A=H++HA-,HA -![]() H++A2-。试回答下列问题:(1)NaHA溶液呈________(填“酸”、“碱”或“中”)性,理由是___________________。
H++A2-。试回答下列问题:(1)NaHA溶液呈________(填“酸”、“碱”或“中”)性,理由是___________________。
(2)某温度下,向10mL、0.1mol/L NaHA溶液中加入0.1mol/L KOH溶液VmL至中性,此时溶液中以下关系一定正确的是_________(填写字母)。
A.溶液pH=7 B.水的离子积Kw=[c2(OH-)]
C.V=10 D.c(K+)<c(Na+)
查看答案和解析>>
科目: 来源: 题型:
【题目】某化学电源的工作原理如图。下列说法不正确的是( )
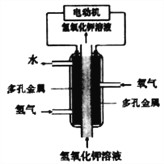
A. 采用多孔金属作电极可增大电极接触面积,提高对气体的吸附能力
B. 通H2的电极作负极,发生氧化反应
C. 通O2的电极发生的电极反应:O2+4e-+4H+=2H2O
D. 该电池工作时发生的主要能量转化形式为化学能转化为电能和热能
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com