
科目: 来源: 题型:
【题目】24mL浓度为0.05molL﹣1的Na2SO3溶液,恰好与20mL浓度为0.02molL﹣1的K2Cr2O7溶液完全反应,已知Na2SO3能被K2Cr2O7氧化为Na2SO4 , 则元素Cr在还原产物中的化合价为( )
A.+2
B.+3
C.+4
D.+5
查看答案和解析>>
科目: 来源: 题型:
【题目】下列叙述中正确的是
A.纯碱(Na2CO3)从物质的分类看不属于碱
B.由一种元素组成的物质一定是单质
C.凡是能电离出H+的化合物均属于酸
D.盐类物质一定含有金属离子
查看答案和解析>>
科目: 来源: 题型:
【题目】甲烷作为一种新能源在化学领域应用广泛,请回答下列问题:
(1)高炉冶铁过程中,甲烷在催化反应室中产生水煤气(CO和H2)还原氧化铁,有关反应为:
CH4(g)+CO2(g)![]() 2CO(g)+2H2(g) △H=260kJmol﹣1
2CO(g)+2H2(g) △H=260kJmol﹣1
已知:2CO(g)+O2(g)![]() 2CO2(g) △H=﹣566kJmol﹣1
2CO2(g) △H=﹣566kJmol﹣1
则CH4与O2反应生成CO和H2的热化学方程式为 。
(2)如图所示,装置Ⅰ为甲烷燃料电池(电解质溶液为KOH溶液),通过装置Ⅱ实现铁棒上镀铜。
①b处电极上发生的电极反应式: ;
②电镀结束后,装置Ⅰ中KOH溶液的浓度 (填写“变大”、“变小”或“不变”),装置Ⅱ中Cu电极上发生的电极反应式: 。
③在此过程中若完全反应,装置Ⅱ中阴极质量变化12.8g,则装置Ⅰ中理论上消耗甲烷 L(标准状况下)。

答
查看答案和解析>>
科目: 来源: 题型:
【题目】下表为元素周期表前4周期的一部分,下列有关R、W、X、Y、Z五种元素的叙述中,正确的是 ( )

A.W、R元素单质分子内都存在非极性键
B.X、Z元素都能形成双原子分子
C.键长W—H<Y—H,键的极性Y—H>W—H
D.键长X—H<W—H,键能X—H<W—H
查看答案和解析>>
科目: 来源: 题型:
【题目】根据氢气分子的形成过程示意图(如下图)回答问题:
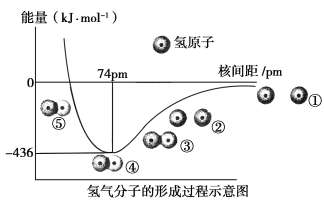
(1)H—H键的键长为________,①~⑤中,体系能量由高到低的顺序是________。
(2)下列说法中正确的是( )
A.氢气分子中含有一个π键
B.由①到④,电子在核间出现的几率增大
C.由④到⑤,必须消耗外界的能量
D.氢气分子中含有一个极性共价键
(3)几种常见化学键的键能如下表:
化学键 | Si—O | H—O | O==O | Si—Si | Si—C |
键能/kJ·mol-1 | 460 | 464 | 498 | 176 | x |
请回答下列问题:
①比较Si—Si键与Si—C键的键能大小:x________(填“>”、“<”或“=”)176。
②H2被称为21世纪人类最理想的燃料,而还有科学家提出硅是“21世纪的能源”、“未来的石油”的观点。试计算:每千克H2燃烧(生成水蒸气)放出的热量约为________;每摩尔硅完全燃烧放出的热量约为________。
查看答案和解析>>
科目: 来源: 题型:
【题目】(1)利用VSEPR推断分子或离子的空间构型。
PO![]() __________;CS2____________;AlBr3(共价分子)__________。
__________;CS2____________;AlBr3(共价分子)__________。
(2)有两种活性反应中间体粒子,它们的粒子中均含有1个碳原子和3个氢原子。请依据下面给出的这两种粒子的球棍模型,写出相应的化学式:
 ______________;
______________; ______________。
______________。
(3)按要求写出第二周期非金属元素构成的中性分子的化学式。
平面三角形分子________,三角锥形分子________,四面体形分子________。
(4)为了解释和预测分子的空间构型,科学家在归纳了许多已知的分子空间构型的基础上,提出了一种十分简单的理论模型——价层电子对互斥模型。这种模型把分子分成两类:一类是____________________;另一类是____________________。
BF3和NF3都是四个原子的分子,BF3的中心原子是________,NF3的中心原子是________;BF3分子的立体构型是平面三角形而NF3分子的立体构型是三角锥形的原因是____________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】下列对化学反应的说法正确的是( )
A.化学反应过程中,分子的种类一定发生改变
B.已知2A(g)+B(g)C(g)+D(s)△H<0,则该反应一定能自发进行
C.有化学键发生断裂,就有化学反应的发生
D.放热反应的反应速率一定比吸热反应的反应速率大
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com