
科目: 来源: 题型:
【题目】反应4NH3(g)+5O2(g)![]() 4NO(g)+6H2O(g),在5 L密闭容器中进行,半分钟后,NO的物质的量增加了0.3 mol,则此反应的平均速率为( )
4NO(g)+6H2O(g),在5 L密闭容器中进行,半分钟后,NO的物质的量增加了0.3 mol,则此反应的平均速率为( )
A. v(O2)=0.01 mol/(L·s) B. v(NO)=0.008 mol/(L·s)
C. v(H2O)=0.003 mol/(L·s) D. v(NH3)=0.004 mol/(L·s)
查看答案和解析>>
科目: 来源: 题型:
【题目】下列说法正确的是( )
A. NaHCO3 受热分解的过程中,只有离子键被破坏
B. Ba(OH)2 中既存在共价键又存在离子键
C. 液态水汽化时,共价键断开,氢键无变化
D. 干冰熔化时破坏共价键和分子间作用力
查看答案和解析>>
科目: 来源: 题型:
【题目】下列叙述能说明X的非金属性比Y强的是( )
A. Y的单质能将X从NaX的溶液中置换出来
B. Y在暗处可与H2反应,X在加热条件下才能与H2反应
C. X 的气态氢化物比Y的气态氢化物稳定
D. X原子的电子层数比Y原子的电子层数多
查看答案和解析>>
科目: 来源: 题型:
【题目】化学与生活密切相关。下列常见物质的俗名与化学式对应正确的是
A. 纯碱—NaOH B. 小苏打——NaHCO3
C. 绿矾—CuSO4·5H2O D. 葡萄糖—C12H22O11
查看答案和解析>>
科目: 来源: 题型:
【题目】
磷存在于人体所有细胞中,是维持骨骼和牙齿的必要物质,几乎参与所有生理上的化学反应。回答下列问题:
(1)基态P原子的核外电子排布式为__________,有______个未成对电子。写出磷及其同周期相邻元素第一电离能的大小顺序_________。
(2)磷的一种同素异形体——白磷(P4)的其键角为_________,推测其在CS2中的溶解度___________(填“大于”或“小于”)在水中的溶解度
(3)两种三角锥形气态氢化物膦(PH3)和氮(NH3)的键角分别为93.6°和107°,试分析PH3、的键角小于NH3的原因_________。写出一种与互为等电子体的阳离子_________。
(4)PCl3中心原子杂化轨道类型为________,VSEPR 模型为_______。
(5)磷化硼(BP)是一种超硬耐磨涂层材料,下图为其立方体晶胞,其中的每个原子均满足8电子稳定结构,试判断其熔点______(填“高于”或“低于”)金刚石熔点。
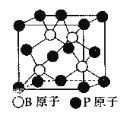
已知其B-P键长均为x cm,则其密度为_____g/cm3(列出计算式即可)
查看答案和解析>>
科目: 来源: 题型:
【题目】在一定条件下的恒容容器发生可逆反应:2A(g)+2B(g)![]() 3C(g)+D(g),反应达化学平衡的标志是( )
3C(g)+D(g),反应达化学平衡的标志是( )
A. 单位时间内生成n mol A,同时生成n mol D
B. B的浓度保持不变
C. 容器内混合气体的密度不随时间而变化
D. 单位时间内消耗n mol B,同时消耗n mol A
查看答案和解析>>
科目: 来源: 题型:
【题目】氧族元素包括氧、硫、硒、碲、钋。
(1)单质硫的同素异形体很多,最常见的是斜方晶硫和单斜晶硫,经过测定,这两种硫的单质都是由S8构成的。S8分子的构型如图所示。S—S键的键角为108°,8个S原子形成两层,每层4个S原子。S8分子中S原子通过 杂化与其他原子成键,斜方晶硫和单斜晶硫中S8分子之间靠 结合在一起。

(2)氧及与其同周期的碳、氮、氟四种原子的第一电离能由大到小的顺序是____________。
(3) 用元素原子电负性的理论判断,H2O中的O—H键的键角 (填“>”、“=”或“<”)H2S中的S—H键的键角。
(4)硒是人体生命活动不可缺少的微量元素,适量的硒能够增强人体免疫力,延缓衰老,清除人体内的有害物质。如图是硒(Se)化锶(Sr)的晶胞模型,据此可知,每个硒化锶晶胞中含有的硒离子为___________个,其化学式为 。

查看答案和解析>>
科目: 来源: 题型:
【题目】FeCl3 具有净水作用,但腐蚀设备,而聚合氯化铁是一种新型的絮凝剂,处理污水比FeCl3 高效,且腐蚀性小。(已知25℃,Ksp[Fe(OH)3]=4.0×10-38,lg2=0.3)
请回答下列问题:
(1)FeCl3净水的原理是 。(用离子方程式表示),Fe3+水解生成的Fe(OH)3胶体粒子能吸附水中的悬浮杂质,常温下此反应的平衡常数为 (填写数值)。
(2)将FeCl3 溶液与NaHCO3 溶液混合,其离子方程式为 。
(3)25℃时pH=3的溶液中,c(Fe3+)= molL-1。
(4)FeCl3 在溶液中分三步水解:
Fe3++H2O![]() Fe(OH)2++H+ K1
Fe(OH)2++H+ K1
Fe(OH)2++H2O![]() Fe(OH)2++H+ K2
Fe(OH)2++H+ K2
Fe(OH)++H2O![]() Fe(OH)3+H+ K3
Fe(OH)3+H+ K3
以上水解反应的平衡常数K1、K2、K3由大到小的顺序是 。
通过控制条件,以上水解产物聚合,生成聚合氧化铁,离子方程式为:xFe3++yH2O![]() Fex+yH+,欲使平衡正向移动可采用的方法是(填序号) 。
Fex+yH+,欲使平衡正向移动可采用的方法是(填序号) 。
a.降温 b.加水稀释 c.加入NH4Cl d.加入NaHCO3
(5) FeCl3溶液可腐蚀印刷电路板,其反应为Cu +2FeCl3 =CuCl2+2FeCl2 要将此反应设计在原电池中进行,则正极反应式为 。
查看答案和解析>>
科目: 来源: 题型:
【题目】反应A(g)+3B(g)![]() 2C(g) (正反应放热)达到平衡后,将气体混合物的温度降低,下列叙述正确的是
2C(g) (正反应放热)达到平衡后,将气体混合物的温度降低,下列叙述正确的是
A. 正反应速率增大,逆反应速率变小,平衡向正反应方向移动
B. 正反应速率变小,逆反应速率增大,平衡向逆反应方向移动
C. 正反应速率和逆反应速率都变小,平衡向正反应方向移动
D. 正反应速率和逆反应速率都变小,平衡向逆反应方向移动
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com