
科目: 来源: 题型:
【题目】下列有关说法中错误的是( )
A. 第三周期从左往右,简单阳离子的半径依次减小
B. 主族元素中原子半径最小和最大的元素在同一族
C. 王水是浓硝酸和浓盐酸以体积比1∶3混合的溶液
D. 将NH3通入水中制成1L 1mol·L-1的氨水,其中NH3、NH4+的物质的量之和为1mol
查看答案和解析>>
科目: 来源: 题型:
【题目】X、Y、Z、M、R为五种短周期元素,其原子半径和最外层电子数之间的关系如下图所示。下列说法错误的是
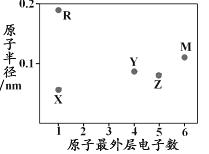
A. R的氧化物含有离子键 B. 最高价含氧酸的酸性:Z<Y
C. M的氢化物常温常压下为气体 D. Y形成的化合物种类最多
查看答案和解析>>
科目: 来源: 题型:
【题目】两种一元碱MOH和ROH的溶液分别加水稀释,溶液pH的变化如图所示,下列叙述不正确的是

A.MOH是一种弱碱
B.在x点,c(M+)=c(R+)
C.稀释前,c(ROH)=10 c(MOH)
D.稀释前MOH溶液和ROH溶液中由水电离出的c(OH﹣)后者是前者的 10倍
查看答案和解析>>
科目: 来源: 题型:
【题目】如图为向25mL 0.1 mol·L-1 NaOH溶液中逐滴滴加0.2 mol·L-1CH3COOH溶液过程中溶液pH的变化曲线。AB区间,c(OH-)>c(H+),则c(OH-)与c(CH3COO-)大小关系是

A.c(OH-)一定大于c(CH3COO-) B.c(OH-)一定小于c(CH3COO-)
C.c(OH-)一定等于c(CH3COO-) D.c(OH-)大于、小于或等于c(CH3COO-)
查看答案和解析>>
科目: 来源: 题型:
【题目】工业废水中常含有一定量的Cr2O72﹣和CrO42﹣,它们会对人类及生态系统产生很大的伤害,必须进行处理。该法的工艺流程为CrO42﹣![]() Cr2O72﹣
Cr2O72﹣![]() Cr3+
Cr3+![]() Cr(OH)3↓ 其中第①步存在平衡:2CrO42﹣(黄色)+2H+
Cr(OH)3↓ 其中第①步存在平衡:2CrO42﹣(黄色)+2H+![]() Cr2O72﹣(橙色)+H2O
Cr2O72﹣(橙色)+H2O
(1)若平衡体系的pH=2,则溶液显 色。
(2)能说明第①步反应达平衡状态的是 。(选填编号)
a.Cr2O72﹣和CrO42﹣的浓度相同 b.v正(Cr2O72﹣)=2v逆(CrO42﹣)
c.溶液的颜色不变 d.溶液的pH值不变
(3)写出第②步中Cr2O72﹣转变为Cr3+的离子方程式: .
(4)向Cr2(SO4)3溶液中,滴加NaOH,当pH=4.6时,开始出现Cr(OH)3沉淀,随着pH的升高,沉淀增多,但当pH≥13时,沉淀消失,出现亮绿色的[Cr(OH)4]﹣离子.其平衡关系如下:H++[Cr(OH)4]﹣(亮绿色)![]() Cr(OH)3(s,灰绿色)+H2O
Cr(OH)3(s,灰绿色)+H2O ![]() Cr3+(紫色)+H2O +3OH﹣.现向0.05mol·L﹣1的Cr2(SO4)3溶液50mL中,加入等体积0.6mol·L﹣1的NaOH溶液,充分反应后,溶液中可观察到的现象为 。
Cr3+(紫色)+H2O +3OH﹣.现向0.05mol·L﹣1的Cr2(SO4)3溶液50mL中,加入等体积0.6mol·L﹣1的NaOH溶液,充分反应后,溶液中可观察到的现象为 。
(5)在Na[Cr(OH)4]和Na2Cr2O7混合后的溶液中加入H2SO4酸化,铬元素以 形式存在(填写离子符号)。
查看答案和解析>>
科目: 来源: 题型:
【题目】将物质的量相等的A、B混合加入2 L的密闭容器中,发生如下反应:3A(气)+B(气) ![]() xC(气)+2D(气)。经5 min后,测得D的浓度为0.5 mol·L-1,c(A)∶c(B)=3∶5,C的平均反应速率是0.1 mol·(L·min)-1。回答下列问题:
xC(气)+2D(气)。经5 min后,测得D的浓度为0.5 mol·L-1,c(A)∶c(B)=3∶5,C的平均反应速率是0.1 mol·(L·min)-1。回答下列问题:
(1)x值是____________。
(2)用B表示5 min内的平均反应速率为__________。
(3)反应开始前加入容器中的A、B的物质的量分别为________。
查看答案和解析>>
科目: 来源: 题型:
【题目】(12分)有X、Y、Z三种短周期元素,已知X的气态氢化物的分子式为H2X,该氢化物的相对分子质量与X最高价氧化物的相对分子质量之比为17∶40,X原子核内质子数与中子数相等;Y与X可形成离子化合物Y2X,Y的阳离子的电子层结构与Ne相同。Z与X处于同一周期,其气态单质是双原子分子,两原子共用一对电子。
(1)写出各元素的符号:X______,Y______,Z______。
(2)X的相对原子质量为____________,其离子的结构示意图为________。
(3)Y单质在空气中燃烧的化学方程式是________________________,该生成物与水反应的化学方程式是______________________。
(4)X与氢气化合的产物的电子式为________。
查看答案和解析>>
科目: 来源: 题型:
【题目】反应Fe+H2SO4===FeSO4+H2↑的能量变化趋势如下图所示:

(1)该反应为________反应(填“吸热”或“放热”)。
(2)若要使该反应的反应速率加快,下列措施可行的是__________(填字母)。
A.改铁片为铁粉 B.改稀硫酸为98%的浓硫酸 C.升高温度
(3)若将上述反应设计成原电池,铜为原电池某一极材料,则铜为________极(填“正”或“负”)。铜电极上产生的现象为____________,该极上发生的电极反应为____________________,外电路中电子由____________极(填“正”或“负”,下同)向________极移动。
查看答案和解析>>
科目: 来源: 题型:
【题目】某课外兴趣小组欲测定某NaOH溶液的浓度,其操作步骤如下:
①将碱式滴定管用蒸馏水洗净后,用待测溶液润洗后,再注入待测溶液,调节滴定管的尖嘴部分充满溶液,并使液面处于“0“刻度以下的位置,记下读数;将锥形瓶用蒸馏水洗净后,用待测溶液润洗锥形瓶2~3次;从碱式滴定管中放入25.00mL待测溶液到锥形瓶中。
②将酸式滴定管用蒸馏水洗净后,立即向其中注入0.1000mol/L标准盐酸,调节滴定管的尖嘴部分充满溶液,并使液面处于“0“刻度以下的位置,记下读数。
③向锥形瓶中滴入酚酞作指示剂,进行滴定。滴定至指示剂刚好变色,且并不马上变色为止,测得所耗盐酸的体积为V1mL。
④重复以上过程,但在滴定过程中向锥形瓶加入5mL的蒸馏水,测得所耗盐酸的体积为V2mL。
试回答下列问题:
(1)锥形瓶中的溶液从 色变为 色时,停止滴定。
(2)滴定时边滴边摇动锥形瓶,眼睛应观察 。
A、滴定管内液面的变化 B、锥形瓶内溶液颜色的变化
(3)该小组在步骤①中的错误是 由此造成的测定结果 (偏高、偏低或无影响)
(4)步骤②缺少的操作是 。
(5)如图,是某次滴定时的滴定管中的液面,其读数为 mL

(6)请计算待测烧碱溶液的浓度 mol/L。
滴定次数 | 待测液体积(mL) | 标准盐酸体积(mL) | |
滴定前度数(mL) | 滴定后度数(mL) | ||
第一次 | 25.00 | 0.50 | 20.40 |
第二次 | 25.00 | 4.00 | 24.10 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com