
科目: 来源: 题型:
【题目】下列各组物质属于同位素的是___________,属于同分异构体的是_________,属于同一物质的是__________。
(1)O2和O3
(2)3517Cl和3717Cl
(3)CH3CH3和CH3CH2CH2CH3
(4)金刚石和石墨
(5)氕、氘、氚
(6)CH3CH2CH2CH(CH3)CH2CH3和CH3CH2CH(CH3)CH(CH3)CH3
(7)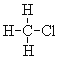 和
和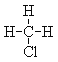
查看答案和解析>>
科目: 来源: 题型:
【题目】下列反应能用H++OH-= H2O 表示的是( )
A. NaOH溶液和CO2的反应 B. Ba(OH)2溶液和稀H2SO4的反应
C. NaHSO4溶液和KOH的反应 D. 石灰乳和稀H2SO4的反应
查看答案和解析>>
科目: 来源: 题型:
【题目】将下列各组物质按酸、碱、盐分类顺序排列,正确的是( )
A.H2SO4 Na2CO3 Ca(OH)2
B.HCl NaOH K2CO3
C.H2CO3 C2H5OH NaHSO4
D.Ba(OH)2 H3PO4 KOH
查看答案和解析>>
科目: 来源: 题型:
【题目】镁在工业、医疗等领域均有重要用途。某化学小组利用硼砂工厂的固体废弃物(主要含有MgCO3、MgSiO3、Al2O3和Fe2O3等),设计了回收其中镁的工艺流程:

(1)酸浸前,将固体废弃物研磨的目的是_______,为达到此目的,还可以采取的措施是_____(任写一条)。
(2)酸浸时,生成滤渣I的离子方程式为_________。
(3)第一次调节pH的目的是_____。当加入氨水使Al3+开始沉淀时,溶液中c(Fe3+)/c(Al3+)为 _________ 。已知Ksp[Fe(OH)3 ]=4×10-38,Ksp[Al(OH)3 ]=1×10-33.
(4)设计简单方案分离滤渣2,简述实验过程:______。
(5)滤液3中可回收利用的物质主要是_____(填化学式),其阳离子的电子式为 _______。
(6)写出工业上从滤渣3中获得镁锭的所有反应的化学方程式:_______。
查看答案和解析>>
科目: 来源: 题型:
【题目】生产、生活中常设计化学知识,下列说法正确的是
A. “海市蜃楼”现象是胶体的丁达尔效应造成的
B. 明矾可用于再来水的净化和消毒
C. 在香蕉箱中放入浸有KMnO4溶液的硅藻土可延长保鲜期
D. 由于碘单质受热易升华,所以炒菜时加碘盐最后放
查看答案和解析>>
科目: 来源: 题型:
【题目】将4 mol A气体和2 mol B气体在2 L固定体积的容器中混合,并在一定条件下发生如下反应∶2A(g)+B(g)![]() 2C(g)。若经2s后测得C的浓度为0.6 mol L-1,现有下列几种说法,其中正确的是
2C(g)。若经2s后测得C的浓度为0.6 mol L-1,现有下列几种说法,其中正确的是
A.用物质A表示的反应的平均速率为0.6 mol (L s)-1
B.2 s时物质B的浓度为1.4 mol L-1
C.2 s时物质A的转化率为70%
D.2 s时物质A的体积分数为![]()
查看答案和解析>>
科目: 来源: 题型:
【题目】下图是不完整的元素周期表。A~H八种元素的位置已确定,完成下列各题。
A | |||||||||||||||||
B | C | D | |||||||||||||||
E | F | G | |||||||||||||||
H | |||||||||||||||||
(1)用实线画出元素周期表的上边界。用阴影表示出非金属元素。(请用黑色水笔书写)__________
(2)用一个置换反应证明F和G的非金属性强弱:(书写离子方程式)_____________。
(3)已知A和C能形成含有18个电子的化合物,其含有的化学键的类型为__________、__________。
(4)已知A和C也能形成CA5的离子化合物,请书写其电子式__________________。
(5)H能与C的最高价氧化物对应的水化物的稀溶液反应,写出反应的离子方程式________________。
(6)判断B的氢化物和E的氢化物的沸点高低:BHm_____________EHm(填“大于”、“等于”或“小于”)。
(7)C的氢化物极易溶于D的氢化物的原因是_____________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】聚对苯二甲酸乙二酯(J)具有良好的力学性能,其薄膜的伸拉强度是聚乙烯薄膜的9倍。它的合成路线如下:
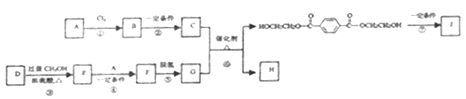
已知:
①![]()
②酯与醇可发生如下酯交换反应:RCOOR′+R〞OH ![]() RCOOR〞+R′OH(R、R′、R〞代表烃基)
RCOOR〞+R′OH(R、R′、R〞代表烃基)
(1)A的产量标志着一个国家石油化工发展水平,反应①的反应类型为______________。
(2)C的分子式是C2H6O2,是汽车防冻液的主要成分。反应②的试剂和反应条件是____________。
(3)D的分子式是C6H6O4,是一种直链结构的分子,核磁共振氢谱有3种峰,D种含有的官能团是______。
(4)F的结构简式是__________________。
(5)反应⑥的化学方程式是_________________。
(6)反应⑦为缩聚反应,反应⑦的化学方程式是_________________。
(7)G是一种同分异构体,G′为甲酸酯,核磁共振氢谱有3种峰且1mol该有机物酸性条件下水解产物能与2molNaOH反应。G′的结构简式为______________。
(8)以对二甲苯、甲醇为起始原料,选用必要的无机试剂合成G,写出合成路线(用结构简式表示有机物,用箭头表示转化关系,箭头上注明试剂和反应条件)___________。
查看答案和解析>>
科目: 来源: 题型:
【题目】(1)化学反应速率是描述化学反应进行快慢程度的物理量。如图是某同学利用稀硫酸和硫代硫酸钠(Na2S2O3)的反应来测定化学反应速率并探究其影响因素的实验。

Ⅰ.测定化学反应速率:已知:S2O![]() +2H+ === H2O+S↓+SO2↑
+2H+ === H2O+S↓+SO2↑
① 除如图装置所示的实验用品外,还需要的一件实验用品是__________。
② 若在2 min时收集到224 mL(标准状况下)气体,可计算出该2 min内H+的反应速率,而该测定值比实际值偏小,其原因是_____________________。
③ 利用该化学反应,试简述一种测定反应速率的其他方法:_______________。
Ⅱ.探究化学反应速率的影响因素:已知 I2+2S2O32- === S4O62- +2I-
为探讨反应物浓度对化学反应速率的影响,设计的实验方案如下表。
(已知Na2S2O3溶液足量)
实验序号 | 体积V/mL | 时间/s | |||
Na2S2O3溶液 | 淀粉溶液 | 碘水 | 水 | ||
① | 10.0 | 2.0 | 4.0 | 0.0 | t1 |
② | 8.0 | 2.0 | 4.0 | 2.0 | t2 |
③ | 6.0 | 2.0 | 4.0 | V | t3 |
④ 表中V =__________mL,t1、t2、t3的大小关系是____________________________。
( 2 ) 恒温条件下,在体积固定的密闭容器中,发生反应X(g)+3Y(g)![]() 2Z(g),若X、Y、Z起始浓度分别为c1、c2、c3(均不为0),平衡时X、Y、Z的浓度分别为0.1molL﹣1、0.3molL﹣1、0.08molL﹣1。
2Z(g),若X、Y、Z起始浓度分别为c1、c2、c3(均不为0),平衡时X、Y、Z的浓度分别为0.1molL﹣1、0.3molL﹣1、0.08molL﹣1。
请回答下列问题:
① c1+c2+c3的取值范围为____________________
② c1:c2的值为__________________ ③下列叙述能证明该反应已达到化学平衡状态的是 __________ A.混合气体密度不再变化 B.v正(X)=2 v逆(Z) C.容器内压强不再发生变化 D.混合气体的平均相对分子质量 E. X的物质的量和Y的物质的量之比
查看答案和解析>>
科目: 来源: 题型:
【题目】金属钛性能优越,被誉为继Fe、Al后应用广泛的“第三金属”。
(1)Ti基态原子的电子排布式为____________。
(2)Ti能与B、C、N、O等非金属元素形成稳定的化合物,B、C、N的电负性由大到小的顺序为_____;C、N、O的第一电离能由大到小的顺序为_____________。
(3)N的氢化物常作制冷剂,原因是______________。
(4)月球岩石—玄武岩的主要成分为钛酸亚铁(FeTiO3)。FeTiO3与80%的硫酸反应可生成TiOSO4。
SO42-的空间构型为_______形。其中硫原子采用_________杂化,写出SO42-的一种等电子体的化学式:______。
(5)Ti、Ca、O相互作用能形成如图晶体结构(Ti4+位于立方体的顶点、Ca2+位于立方体体心),该晶体的化学式为________。Ti4+和周围_____个O2-相紧邻。该晶胞的边长为apm,则其密度为______g/cm3。

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com