
科目: 来源: 题型:
【题目】新型锂电池正极材料锰酸锂(LiMn2O4)有望取代广泛使用的LiCoO2。工业上用某软锰矿(主要成分为MnO2,同时含有少量铁、铝及硅等的氧化物)为原料制备锰酸锂的流程如下:

有关物质的溶度积常数
物质 | Fe(OH)2 | Fe(OH)3 | Al(OH)3 | Mn(OH)2 |
Ksp | 8.0×10-16 | 4.0×l0-38 | 4.5×10-33 | 1.9×l0-13 |
(1)已知,锂电池放电正极的电极反应为:LiMn2O4+e-+Li+= Li2Mn2O4,则锂电池正极材料锰酸锂中,锰元素的化合价为________。
(2)流程中,FeSO4的作用是_______,MnO的作用是_________,当滤液中的pH为6时,滤液中所含铝离子的浓度为___________。
(3)采用下图装置电解,离子交换膜将电解池分隔为阳极室和阴极室,两室的溶液分别为硫酸钠溶液和制得的硫酸锰溶液,则阴极室中的溶液为________;电解产生的MnO2沉积在电极上,该电极反应式为_________。

(4)若将上述装置中的硫酸钠溶液换为软锰矿的矿浆,并加入适量的硫酸铁及硫酸,可一次性完成软锰矿的浸出反应与电解沉积MnO2反应,电解时,Fe3+先放电生成Fe2+,产生的Fe2+再与矿浆中的 MnO2反应,周而复始,直至矿浆中的MnO2完全浸出。则Fe2+与矿浆中MnO2反应的离子方程式为__________。
(5)写出高温煅烧生成锰酸锂的化学方程式___________。
查看答案和解析>>
科目: 来源: 题型:
【题目】已知:I2在水中溶解度很小,在KI溶液中溶解度显著增大。 I2在KI溶液中存在下列平衡:I2(aq)+I-(aq) ![]() I3 -(aq)。测得不同温度下该反应的平衡常数如下图所示,下列说法正确的是( )
I3 -(aq)。测得不同温度下该反应的平衡常数如下图所示,下列说法正确的是( )

A.反应I2(aq)+I-(aq) ![]() I3 -(aq)的ΔH>0
I3 -(aq)的ΔH>0
B.利用该反应可以除去硫粉中少量的碘单质
C.在上述平衡体系中加入苯,平衡不移动
D.25℃时,在上述平衡体系中加入少量KI固体,平衡常数K小于680
查看答案和解析>>
科目: 来源: 题型:
【题目】NOx会引起光化学烟雾等环境问题,在催化剂存在条件下,以NH3或尿素将尾气中NOx
还原为N2的技术,即NH3或尿素-SCR技术,是去除NOx最为有效且应用最广的技术之一,其中最重要的催化剂体系是钒基催化剂。
(1)NH3去除尾气中的NOx,当v(NO):v(NO2)=l:1时称为“快速SCR 反应”,该反应化学方程式为___________。
(2)不同钒含量的催化剂(V2O5/TiO2)添加WO3对NO去除率的影响如下图,从图中可以得出其它条件相同时添加WO3,对NO去除率的影响是_____(填“增大”、“减小”或“无影响”)。根据图中所示,随着温度升高NO去除率的变化趋势为_____,该变化趋势的一种可能原因是___________。

(3)在制备钒基催化剂时,添加的各种成型助剂中碱金属或碱土金属(如Na、K、Ca)能够使催化剂中毒(催化性能下降), K、Ca的毒化作用与Na相似。下列适合做成型助剂有_____。
A.Li B.Mg C.酸性铝溶胶 D.酸性硅溶胶
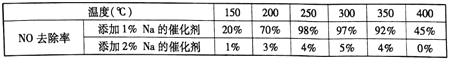
请设计实验研究添加金属K对催化剂活性的影响(只需写出实验思路,不需要具体实验
操作)_____________。
(4)在NOx催化去除过程中,NH3储罐存在危险性,更多应用为尿素-SCR技术。在该技术过程中,发生如下两个反应:
① CO(NH2)2=NH3+HNCO
② HNCO(g)+H20(g)====NH3(g)+CO2(g)
在此过程中一分子尿素可以生成两分子NH3,因此尿素被视为是NH3的有效储存源。反应②的平衡常数表达式为_______。目前商用的尿素溶液浓度为32.5%(密度为1.05g/mL),常称为“Ad Blue ”。1L该商用尿素溶液发生“快速SCR反应”, 理论上最多可消除NO和NO2在标准状况下的体积为______L。
查看答案和解析>>
科目: 来源: 题型:
【题目】下列关于有机物的说法错误的是
A. CCl4可由CH4制得,可萃取碘水中的碘
B. 30℃甲苯与浓硫酸浓硝酸混合,反应的主要产物为邻硝基甲苯和对硝基甲苯
C. 乙酸乙酯中的少量乙酸可用饱和Na2CO3溶液除去
D. 苯不能使KMnO4溶液褪色,因此苯不能发生氧化反应
查看答案和解析>>
科目: 来源: 题型:
【题目】下列有关核酸的叙述,正确的是 ( )
A. 某些原核生物的遗传物质是RNA
B. HIV (艾滋病病毒)的核酸中,有5种碱基
C. DNA两条链上有一个游离的磷酸基
D. 组成DNA、ATP和磷脂分子的元素种类相同
查看答案和解析>>
科目: 来源: 题型:
【题目】下列化学反应的离子方程式正确的是
A.铁和稀盐酸反应:2Fe+6H+=2Fe3++3H2↑
B.铜与稀硫酸反应:Cu+2H+=Cu2+ +H2↑
C.实验室制取CO2气体:CO32-+2H+=CO2↑+H2O
D.铁与硫酸铜溶液反应:Fe+Cu2+=Fe2++Cu
查看答案和解析>>
科目: 来源: 题型:
【题目】在强酸性溶液中能大量共存且溶液为无色透明的一组离子的是
A.Cu2+、Na+、CO32-、SO42-
B.K+、Cl-、Na+、SO42-
C.Na+、NO3-、HCO3-、K+
D.Fe2+、MnO4-、Cl-、Na+
查看答案和解析>>
科目: 来源: 题型:
【题目】过氧化钙可以用于改善地表水质、处理含重金属粒子废水和治理赤潮,也可用于应急供氧等。实验室可用工业碳酸钙(含MgCO3、FeCO3等杂质)制取纯净的碳酸钙,然后再用纯的碳酸钙制取过氧化钙,其主要流程如下:
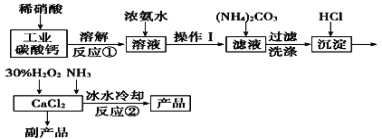
已知:CaO2·8H2O呈白色微溶于水。
(1)写出反应①中氧化还原反应的离子方程式: ______________。
(2)向反应①后的溶液中加浓氨水的目的是: __________________。
(3)反应②常用冰水控制温度在0℃左右,其可能原因是(写出两种):
①__________________;②______________。
(4)测定产品中CaO2的含量的实验步骤是
第一步:准确称取a g产品于有塞锥形瓶中,加入适量蒸馏水和过量的b g KI晶体,再滴入少量2 mol/L的H2SO4溶液,充分反应。
第二步:向上述锥形瓶中加入几滴淀粉溶液。
第三步:逐滴滴入浓度为c mol·L-1的Na2S2O3标准溶液至反应终点,消耗Na2S2O3溶液V mL。
已知:I2+2S2O![]() ===2I-+S4O
===2I-+S4O![]() 。
。
①滴定终点的现象为____________,产品中CaO2的质量分数为_________________
②某同学第一步和第二步的操作都很规范,第三步滴速太慢,这样测得的CaO2的质量分数可能________ (填“不受影响”“偏低”或“偏高”),原因是_____________.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com