
科目: 来源: 题型:
【题目】(1)一定条件下1 L的密闭容器中,反应mA(g)+nB(g) ![]() pC(g)+qD(g)达到平衡。若起始时A为1 mol,反应2min达到平衡,A剩余0.4 mol,则在0~2min内A的平均反应速率为______mol/(Lmin)。
pC(g)+qD(g)达到平衡。若起始时A为1 mol,反应2min达到平衡,A剩余0.4 mol,则在0~2min内A的平均反应速率为______mol/(Lmin)。
(2)在其他条件不变的情况下,扩大容器体积,若平衡向逆反应方向移动,m+n______p+q(选填“>”、“<”或“=”),v逆______(选填“增大”、“减小”或“不变”)。
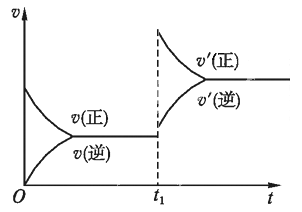
(3)若反应速率(v)与时间(t)的关系如图所示,则导致t1时刻速率发生变化的原因可能是________。(选填编号,下同)
a.增大A的浓度 b. 缩小容器体积
c. 加入催化剂 d.升高温度
(4)若nV正(A)=mV逆(B),则该反应________。
a.向正反应方向进行 b. 向逆反应方向进行 c.处于平衡状态 d.无法判断
查看答案和解析>>
科目: 来源: 题型:
【题目】环境监测显示,某地市的主要气体污染物为SO2、NOx、CO等,其主要来源为燃煤、机动车尾气。进行如下研究:
(1)为减少燃煤对SO2的排放,可将煤转化为清洁燃料水煤气(CO和H2)。
已知:![]() ΔH=241.8kJ·mol-1,
ΔH=241.8kJ·mol-1,
![]() ΔH=-110.5kJmol-1
ΔH=-110.5kJmol-1
写出焦炭与1mol水蒸气反应生成水煤气的热化学方程式:________。
(2)汽车尾气中NO是在发动机汽缸中生成的,反应为N2(g)+O2(g)![]() 2NO(g) ΔH>0。
2NO(g) ΔH>0。
①将含0.8molN2和0.2molO2(近似空气组成)的混合气体充入某密闭容器中,保持1300℃反应达到平衡,测得生成8×10-4molNO。计算该温度下此反应的化学平衡常数K=________(填近似计算结果)。
②汽车启动后,汽缸内温度越高,单位时间内NO排放量越大,原因是________.
(3)利用如图所示装置(电极均为惰性电极)可吸收SO2,并利用阴极排出的溶液吸收NO2。

①电极A的电极反应式为________;
电极B的电极反应式为________。
②碱性条件下,用阴极排出的溶液吸收NO2,使其转化为无害气体,同时生成SO32-。该反应的离子方程式为________。
查看答案和解析>>
科目: 来源: 题型:
【题目】用氮化硅(Si3N4)陶瓷代替金属制造发动机的耐热部件,能大幅度提高发动机的热效率。工业上用化学气相沉积法制备氮化硅,其反应如下:3SiCl4(g)+2N2(g)+6H2(g) =Si3N4(s)+12HCl(g)+Q(Q>0)完成下列填空:
(1)写出N2的电子式:___________________,写出SiCl4的结构式:______________。
(2)由氮化硅(Si3N4)陶瓷的用途可推测其晶体类型为________。
a.离子晶体 b. 原子晶体 c.分子晶体 d.金属晶体
(3)在一定温度下进行上述反应,若反应容器的容积为2 L,3 min后达到平衡,测得固体的质量增加了2.80 g,则H2的平均反应速率___ mol/(L·min)。
(4)一定条件下,在密闭恒容的容器中,能表示上述反应达到化学平衡状态的是______。
a.3v逆(N2)=v正(H2) b.v正(HCl)=4v正(SiCl4)
c.混合气体密度保持不变 d.c(N2):c(H2):c(HCl)=1:3:6
(5)上述反应达到平衡后,下列说法正确的是________。
a.其他条件不变,压强增大,正反应速率减小
b.其他条件不变,温度升高,正、逆反应速率都增大
c.其他条件不变,增大Si3N4物质的量平衡向左移动
d.其他条件不变,增大HCl物质的量平衡向左移动
(6)若平衡时H2和HCl的物质的量之比为![]() ,保持其它条件不变,降低温度后达到新的平衡时,H2和HCl的物质的量之比___
,保持其它条件不变,降低温度后达到新的平衡时,H2和HCl的物质的量之比___![]() (填“>”、“=”或“<”)。
(填“>”、“=”或“<”)。
查看答案和解析>>
科目: 来源: 题型:
【题目】在一个容积固定的密闭容器中,发生反应:CO(g)+2H2(g) ![]() CH3OH(g)+Q(Q>0).第2 min时只改变一个条件,反应情况如下表
CH3OH(g)+Q(Q>0).第2 min时只改变一个条件,反应情况如下表

下列说法不正确的是 ( )
A. 第4 min至第6 min该化学反应处于平衡状态
B. 第2 min时,如果只改变某一条件,则改变的条件可能是降低温度
C. 第2 min时,如果只改变某一条件,则改变的条件可能是使用催化剂
D. 第6 min时,其他条件不变,如果升高温度,正反应速率增大
查看答案和解析>>
科目: 来源: 题型:
【题目】某密闭容器中充入等物质的量的气体A和B,一定温度下发生反应A(g)+xB(g) ![]() 2C(g),达到平衡后,只改变反应的一个条件,测得容器中各物质的浓度、反应速率随时间变化的关系如图所示。下列说法正确的是( )
2C(g),达到平衡后,只改变反应的一个条件,测得容器中各物质的浓度、反应速率随时间变化的关系如图所示。下列说法正确的是( )

A. 前20min B的平均反应速率为0.05mol·L-1·min-1
B. 8 min时表示正反应速率等于逆反应速率
C. 反应方程式中的x=1,30 min时表示增大压强
D. 40 min时改变的条件是升高温度,且正反应为吸热反应
查看答案和解析>>
科目: 来源: 题型:
【题目】反应4CO(g)+2NO2(g) ![]() N2(g)+4CO2(g)开始进行时,CO的浓度为4 mol·L-1,N2的浓度为0,2 min后测得N2的浓度为0.6 mol·L-1,则此段时间内,下列反应速率表示正确的是( )
N2(g)+4CO2(g)开始进行时,CO的浓度为4 mol·L-1,N2的浓度为0,2 min后测得N2的浓度为0.6 mol·L-1,则此段时间内,下列反应速率表示正确的是( )
A. v(CO2)=1.2 mol·(L·min)-1 B. v(NO2)=0.3 mol·(L·min)-1
C. v(N2)=0.6 mol·(L·min)-1 D. v(CO)=1.2 mol·(L·s)-1
查看答案和解析>>
科目: 来源: 题型:
【题目】某实验小组用0.50 mol/L NaOH溶液和0.50 mol/L硫酸溶液进行中和热的测定。
Ⅰ.配制0.50 mol/L NaOH溶液
若实验中大约要使用245 mL NaOH溶液,至少需要称量NaOH固体_____g。
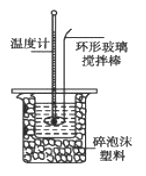
Ⅱ.测定稀硫酸和稀氢氧化钠中和热的实验装置如图所示。
(1)写出该反应的热化学方程式(中和热为57.3 kJ/mol):_____________。
(2)取50 mL NaOH溶液和30 mL硫酸溶液进行实验,实验数据如下表。
①请填写下表中的空白:
起始温度t1/℃ | 终止温度 t2/℃ | 温度差平均值 (t2-t1)/℃ | |||
H2SO4 | NaOH | 平均值 | |||
1 | 26.2 | 26.0 | 26.1 | 30.1 | ______ |
2 | 27.0 | 27.4 | 27.2 | 33.3 | |
3 | 25.9 | 25.9 | 25.9 | 29.8 | |
4 | 26.4 | 26.2 | 26.3 | ||
②近似认为0.50 mol/L NaOH溶液和0.50 mol/L硫酸溶液的密度都是1 g/cm3,中和后生成溶液的比热容c=4.18 J/(g·℃)。则中和热△H=______________取小数点后一位)。
③上述实验数值结果与57.3 kJ/mol有偏差,产生偏差的原因可能是:______。
A.实验装置保温、隔热效果差
B.量取NaOH溶液的体积时仰视读数
C.分多次把NaOH溶液倒入盛有硫酸的小烧杯中
D.用温度计测定NaOH溶液起始温度后直接测定H2SO4溶液的温度
查看答案和解析>>
科目: 来源: 题型:
【题目】请参考题中图表,已知E1=134 kJ·mol-1、E2=368 kJ·mol-1,根据要求回答问题:
(1)图Ⅰ是1 mol NO2(g)和1 mol CO(g)反应生成CO2和NO过程中的能量变化示意图,若在反应体系中加入催化剂,反应速率增大,E1的变化是__________(填“增大”、“减小”或“不变”,下同),ΔH的变化是__________。请写出NO2和CO反应的热化学方程式___________________。

(2)甲醇质子交换膜燃料电池中将甲醇蒸汽转化为氢气的两种反应的热化学方程式如下:
①CH3OH(g)+H2O(g)==CO2(g)+3H2(g) ΔH=+49.0 kJ·mol-1
②CH3OH(g)+![]() O2(g)==CO2(g)+2H2(g) ΔH=-192.9 kJ·mol-1
O2(g)==CO2(g)+2H2(g) ΔH=-192.9 kJ·mol-1
且H2O(g)==H2O(l) ΔH=-44 kJ·mol-1,则甲醇蒸汽燃烧为液态水的热化学方程式为_______________。
(3)如表所示是部分化学键的键能参数:
化学键 | P—P | P—O | O===O | P===O |
键能/kJ·mol-1 | a | b | c | x |

已知白磷的燃烧热为d kJ·mol-1,白磷及其完全燃烧的产物的结构如图Ⅱ所示,则表中x=__________ kJ·mol-1(用含a、b、c、d的代表数式表示)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com