
科目: 来源: 题型:
【题目】工业上吸收工业尾气SO2和NO,可获得Na2S2O4和NH4NO3产品的流程图如下(Ce为铈元素):

(1)Na2S2O4中S元素的化合价为________。
(2)写出装置Ⅱ中反应的离子方程式______________________________。
(3)装置Ⅲ中电解槽阴极发生的电极反应为_______________________________。
(4)从装置Ⅳ获得粗产品NH4NO3的实验操作依次为________、________、过滤、洗涤等。
查看答案和解析>>
科目: 来源: 题型:
【题目】雾霾天气严重影响人们的生活质量,其中氮氧化物和硫氧化物是造成雾霾天气的主要原因之一。消除氮氧化物和硫氧化物有多种方法。
(1)氮、氧元素非金属性较强的是________。
(2)NH3催化还原氮氧化物(SCR)技术是目前应用最广泛的烟气氮氧化物脱除技术。反应原理如图1所示:

①由图1可知SCR技术中的氧化剂为________。
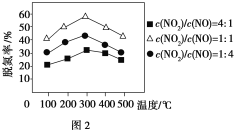
②用Fe作催化剂时,在氨气足量的情况下,不同c(NO2)/c(NO)对应的脱氮率如图2所示,脱氮效果最佳的c(NO2)/c(NO)=________。
(3)海水具有良好的吸收SO2的能力,其吸收过程如下:
①SO2溶于海水生成H2SO3,H2SO3最终会电离出SO![]() ,SO
,SO![]() 可以被海水中的溶解氧氧化为SO
可以被海水中的溶解氧氧化为SO![]() 。海水的pH会________(填“升高”“不变”或“降低”)。
。海水的pH会________(填“升高”“不变”或“降低”)。
②SO2和O2在H2SO4溶液中可以构成原电池,其负极反应式是_____________________。
(4)碲(Te)为第ⅥA族元素,是当今高新技术新材料的主要成分之一。工业上可将SO2通入TeCl4的酸性溶液中进行“还原”得到碲,该反应的化学方程式是___________________
________________________________________________________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】我国科技创新成果斐然,下列成果中获得诺贝尔奖的是( )
A.徐光宪建立稀土串级萃取理论
B.屠呦呦发现抗疟新药青蒿素
C.闵恩泽研发重油裂解催化剂
D.侯德榜联合制碱法
查看答案和解析>>
科目: 来源: 题型:
【题目】将分别盛有熔融的氯化钾、氯化镁、氧化铝的三个电解槽串联,在一定条件下通电一段时间后,析出钾、镁、铝的物质的量之比为( )
A.1:2:3
B.3:2:1
C.6:3:1
D.6:3:2
查看答案和解析>>
科目: 来源: 题型:
【题目】实验室模拟合成硫酸的流程如下:

从下图中选择制取气体的合适装置:

(1)装置C的名称为_________________,实验室通常能用装置C制备_________。
A.H2 B.H2S C.CO2 D.O2
(2)实验室用装置D制备NH3的化学方程式为_______________________________。
(3)若用装置B制备SO2,可以选用试剂为___________。
A、浓硫酸、亚硫酸钠固体 B.浓硫酸、铜片
C.稀硫酸、亚硫酸溶液 D.浓硫酸、铁屑
(4)SO2和O2通过甲装置,甲装置的作用除了可以控制SO2、O2的流速外,还可以__________。

(5)若将一定量的SO2(g)和O2(g)分别通入到体积为2L的恒容密闭容器中,在不同温度下进行反应得到如下表中的两组数据:
实验编号 | 温度/℃ | 起始量/mol | 平衡量/mol | ||
SO2 | O2 | SO2 | O2 | ||
1 | T1 | 4 | 2 | x | 0.8 |
2 | T2 | 4 | 2 | 0.4 | y |
表中x=_______mol,y=_______mol,T1______T2(填“>”、“=”或“<”)
(6)SO2尾气可用NaOH溶液吸收,得到Na2SO3和NaHSO3两种盐。若一定物质的量的SO2与氢氧化钠溶液反应,所得溶液中Na2SO3和NaHSO3的物质的量之比为2:3,则参加反应的SO2和NaOH的物质的量之比为________。
A. 5:7 B.1:2 C.9:4 D.9:13
(7)硫酸与氨水反应生成硫酸铵或硫酸氢铵,现称取(NH4)2SO4和NH4HSO4混合物样品7.58 g,加入含0.1 molNaOH的溶液,发生反应:①OH-+H+→H2O, ②OH-+NH4+→NH3↑+H2O。充分反应,生成1792 mL(标准状况)。已知①优先反应,则样品中(NH4)2SO4的物质的量为_______mol,NH4HSO4的物质的量为_______mol。
查看答案和解析>>
科目: 来源: 题型:
【题目】某同学在常温下设计如下实验流程探究Na2S2O3的化学性质。
pH=8![]()
![]()
![]()
![]()
(1)实验①可说明________(填字母)。
a.该Na2S2O3溶液中水电离的c(OH-)=10-8mol·L-1
b.H2S2O3是一种弱酸
c.Na2S2O3是一种弱电解质
d.Na2S2O3的水解方程式为S2O![]() +2H2OH2S2O3+2OH-
+2H2OH2S2O3+2OH-
(2)写出实验②发生反应的离子方程式:_____________________________。
(3)Na2S2O3溶液中加入盐酸有淡黄色沉淀和刺激性气味的气体生成,写出该反应的离子方程式:_________________________________。
(4)实验室制得的Na2S2O3·5H2O粗产品中往往含有少量杂质。为了测定粗产品中Na2S2O3·5H2O的含量,一般在酸性条件下用KMnO4标准溶液滴定(假设粗产品中杂质与酸性KMnO4溶液不反应)。称取1.28 g粗样品溶于水,用0.40 mol·L-1 KMnO4标准溶液(加入适量硫酸酸化)滴定,当溶液中S2O![]() 全部被氧化时,消耗KMnO4溶液体积20.00 mL(5S2O
全部被氧化时,消耗KMnO4溶液体积20.00 mL(5S2O![]() +8MnO
+8MnO![]() +14H+===8Mn2++10SO
+14H+===8Mn2++10SO![]() +7H2O)。试回答:
+7H2O)。试回答:
①此滴定实验是否需要指示剂?_______(填“是”或“否”)。KMnO4溶液置于________(填“酸式”或“碱式”)滴定管中。
②若滴定时振荡不充分,刚看到溶液局部变色就停止滴定,则会使样品中Na2S2O3·5H2O的质量分数的测量结果________(填“偏高”“偏低”或“不变”)。
③产品中Na2S2O3·5H2O的质量分数为___________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】汽车尾气中含有CO、NO2等有毒气体,对汽车加装尾气净化装置,可使有毒气体相互反应转化成无毒气体。
(1)当空燃比(空气与燃油气的体积比)不同时,汽车尾气的主要成分不同。空燃比较小时的有毒气体主要是________(填化学式)。
(2)某分子筛类催化剂(H+交换沸石)催化NH3脱除NO、NO2的反应机理如图所示。

步骤③转化反应的离子方程式是________________。按上图反应机理,NH3脱除NO、NO2总反应的化学方程式是_____________________________。
(3)NaClO2溶液将NO转化为HNO3的反应历程如下:
NaClO2+HCl===HClO2+NaCl
8HClO2===6ClO2↑+Cl2↑+4H2O
2NaClO2+Cl2===2NaCl+2ClO2↑
5NO+3ClO2+4H2O===5HNO3+3HCl
则酸性条件下NaClO2溶液将NO转化为HNO3的总反应的化学方程式为______________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com