
科目: 来源: 题型:
【题目】若ABn型分子的中心原子A上没有未用于形成共价键的孤对电子,运用价层电子对互斥模型,下列说法正确的是( )
A.若n=2,则分子的立体构型为V形 B.若n=3,则分子的立体构型为三角锥形
C.若n=4,则分子的立体构型为正四面体形 D.以上说法都不正确
查看答案和解析>>
科目: 来源: 题型:
【题目】设NA为阿伏伽德罗常数的数值,下列说法正确的是
A. 常温常压下,14 g C2H4、C3H6的混合气体中含有碳原子的数目为NA
B. 常温下, pH =12的Na2CO3溶液中含有的OH-离子数为0. 01NA
C. 标准状况下,0.56 L丙烷中含有共价键的数目为0.2 NA
D. 7.8 g Na2O2中含有的阴离子数为0.2NA
查看答案和解析>>
科目: 来源: 题型:
【题目】下述实验方案能达到实验目的的是( )
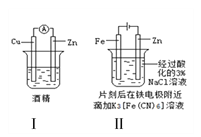
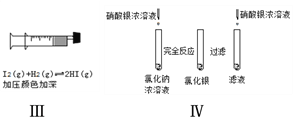
A. 方案Ⅰ验证金属活泼性:Zn>Cu
B. 方案Ⅱ验证Fe电极被保护
C. 方案Ⅲ验证平衡移动原理
D. 方案Ⅳ验证氯化银在水中存在溶解平衡
查看答案和解析>>
科目: 来源: 题型:
【题目】在密闭容器中发生反应:X+2Y![]() 2Z(△H<0),其中Z呈气态,且Z在平衡混合气中的体积分数(Z%)与温度(T)、压强(P)的关系如图,下列判断正确的是
2Z(△H<0),其中Z呈气态,且Z在平衡混合气中的体积分数(Z%)与温度(T)、压强(P)的关系如图,下列判断正确的是

A. Y一定呈气态
B. T1大于T2
C. 升高温度,该反应的化学平衡常数增大
D. 当c(X):c(Y):c(Z)=1:2:2时,反应达到平衡状态
查看答案和解析>>
科目: 来源: 题型:
【题目】已知H2CO3、CH3COOH和HCOOH的电离常数分别为4.3×10-7(Ka1)、1.8×10-5、1.7×10-4。等体积、浓度均为0.1 mol·L-1的三种溶液:①CH3COOH溶液 ②HCOOH溶液 ③NaHCO3溶液,将①、②分别与③混合。下列说法正确的是( )
A.相同浓度的甲酸、乙酸和碳酸中酸性最强的是CH3COOH
B.实验测得产生的CO2气体体积(V)随时间(t)变化的曲线如图所示

C.上述三种溶液中由水电离的c(OH-)大小:NaHCO3>CH3COOH>HCOOH
D.①与③混合后所得溶液中:c(CH3COO-)+c(CH3COOH)=0.10 mol·L-1
查看答案和解析>>
科目: 来源: 题型:
【题目】某食用白醋是由醋酸与纯水配制而成,用中和滴定的方法准确测定其中醋酸的物质的量浓度。实验步骤:①配制500mL浓度约为0.1 mol·L-1的NaOH溶液;②用KHC8H4O4标准溶液准确测定该NaOH溶液的浓度;③用已知准确浓度的NaOH溶液测定醋酸的浓度。
(1)称量所需的NaOH固体置于大烧杯中,加入500mL蒸馏水,搅拌溶解。该配制步骤 (填“可行”或“不可行”)。
(2)称量时NaOH在空气中极易吸水,配制所得的NaOH溶液浓度通常比预期 (填“小”或“大”),这是不能直接配制其标准溶液的原因。
(3)查阅白醋包装说明,醋酸含量约为6g/100mL,换算成物质的量浓度约为 mol·L-1,滴定前将白醋稀释 (填“10”或“100”)倍。(已知醋酸的相对分子质量为60)
(4)稀释白醋时需要的仪器有烧杯、玻璃棒、滴管、酸式滴定管、 。
(5)准确量取稀释后的白醋20.00mL,置于250mL锥形瓶中,加水30mL,再滴加酚酞指示剂,用上述NaOH标准溶液滴定至 即为终点。重复滴定两次,平均消耗NaOH标准溶液V mL(NaOH溶液浓度为c mol·L-1)。
(6)原白醋中醋酸的物质的量浓度= mol·L-1。
查看答案和解析>>
科目: 来源: 题型:
【题目】欲除去CuSO4·5H2O中的沙子,必要的实验操作为( )
A. 溶解 过滤 蒸发结晶 B. 加热 溶解 过滤
C. 溶解 过滤 蒸馏 D. 溶解 过滤 分液
查看答案和解析>>
科目: 来源: 题型:
【题目】下列推理正确的是( )
A.铝粉在氧气中燃烧生成Al2O3,故钠在氧气中燃烧生成Na2O
B.铁能从硫酸铜溶液中置换出铜,故钠也能从硫酸铜溶液中置换出铜
C.活泼金属钠保存在煤油中,故活泼金属铝也保存在煤油中
D.钠与氧气、水等反应时钠均作还原剂,故金属单质参与反应时金属单质均作还原剂
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com