
科目: 来源: 题型:
【题目】半水煤气是工业合成氨的原料气,其主要成分为H2、CO、CO2、N2和H2O(g)。半水煤气经过下列步骤转化为合成氨的原料。
![]()
(1)步骤I,CO变换反应的能量变化如下图所示:

①CO变换反应的热化学方程式是________________。
②一定条件下,向体积固定的密闭容器中充入aL半水煤气,发生CO变换反应。测得不同温度(T1,T2)氢气的体积分数ψ(H2)与时间的关系如下所示。
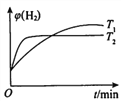
i.T1、T2的大小关系及判断理由是______________。
ii.请在上图中画出:其他条件相同时,起始充入0.5aL半水煤气,T2温度下氢气的体积分数ψ( H2)随时间的变化曲线。______________
(2)步骤Ⅱ,用饱和Na2CO3溶液作吸收剂脱除CO2时,初期无明显现象,后期有固体析出。
①溶液中离子浓度关系正确的是__________(选填字母)。
a.吸收前:c(Na+)>c(CO32-)>c(OH-)>c(HCO3-)
b.吸收初期:2c(CO32-)+2 c(HCO3-)+2c(H2CO3)=c(Na+)
c.吸收全进程:c(Na+)+c( H+)=2c(CO32-)+ c(HCO3-)+ c(OH-)
②后期析出固体的成分及析出固体的原因是___________。
③当吸收剂失效时,请写出一种可使其再生的方法(用化学方程式表示):____________。
查看答案和解析>>
科目: 来源: 题型:
【题目】锰元素在溶液中主要以Mn2+(很浅的肉色,近乎无色)、MnO42-(绿色)、MnO4-(紫色)形式存在。MnO2不溶于稀硫酸。
(1)将8 mL 0.1 mol·L-1的酸性高锰酸钾溶液和2 mL l.0mol/L的草酸(H2C2O4)溶液在试管中混合,然后将试管置于25℃水浴中,KMnO4溶液浓度随时间变化关系如下图所示。
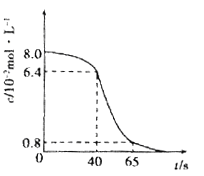
① 写出发生反应的离子方程式:____________
② 计算前40秒用草酸表示的平均反应速率v(草酸)=________________.
③ 40s-65s的反应速率比前40s快,解释原因___________
(2)已知反应3MnO42-+2H2O![]() MnO2+2MnO4-+4OH-。
MnO2+2MnO4-+4OH-。
① 向MnO4-溶液中加入足量稀硫酸,可观察到的现象是__________.
② 常温下,在0.512 mol/L K2MnO4溶液中,当pH=14时K2MnO4的转化率为4/9,则该反应的平衡常数的值为__________
③ 在其他条件不变的条件下,适当升温有利于降低K2MnO4的转化率,则该反应的△H___0(填“大于” “小于”或“等于”)。
(3)碳酸锰是一种重要的工业原料。工业生产中常用复分解法生产MnCO3:
MnSO4+2NH4HCO3=MnCO3↓+(NH4)2SO4+CO2↑+H2O。反应中通常需加入稍过量的NH4HCO3,且控制溶液的pH为6.8-7.4. 溶液的pH不能过低也不能过高,原因是_______。设MnSO4溶液为0.19mol/L,则溶液的pH 最高不能超过_________。
[己知MnCO3、Mn(OH)2的Ksp分别为l.8×10-11和1.9×10-13]
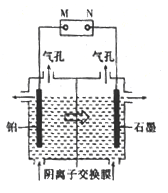
(4)制备单质锰的实验装置如图,阳极以稀硫酸为电解液,阴极以硫酸锰和硫酸混合液为电解液,电解装置中“![]() ”表示溶液中阴离子移动的方向。铂电极的电极反应式为______。
”表示溶液中阴离子移动的方向。铂电极的电极反应式为______。
查看答案和解析>>
科目: 来源: 题型:
【题目】资料显示“O2的氧化性随溶液pH的增大逐渐减弱”。某兴趣小组探究不同条件下KI与O2的反应.实验如下。
装置 | 烧杯中的液体 | 现象(5分钟后) |
| ①2 mL1 mol/LKI溶液+5滴淀粉 | 无明显变化 |
②2 mL1 mol/LKI溶液+5滴淀粉+2 mL0.2 mol/L HCl | 溶液变蓝 | |
③2 mL1 mol/LKI溶液+5滴淀粉+2 mL0.2 mol/L KCl | 无明显变化 | |
④2 mL1 mol/LKI溶液+5滴淀粉+2 mL0.2 mol/L CH3COOH | 溶液变蓝,颜色较②浅 |
(1)实验②中生成I2的离子方程式是___________。
(2)实验③的目的是_________________________________________________________________。
(3)实验④比②溶液颜色浅的原因是________。
(4)为进一步探究KI与O2的反应,用上表中的装置继续进行实验:
烧杯中的液体 | 现象(5小时后) |
⑤2 mLpH=8.5混有KOH的1mol/L KI溶液+5滴淀粉 | 溶液才略变蓝 |
⑥2 mLpH=10混有KOH的1mol/L KI溶液+5滴淀粉 | 无明显变化 |
I.对于实验⑥的现象.甲同学提出猜想“pH=10时O2不能氧化I-”,设计了下列装置进行实验,验证猜想。
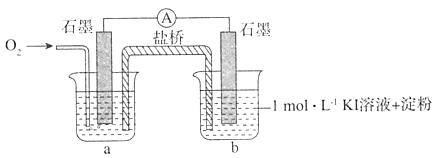
i.烧杯a中的溶液为____。
ii.实验结果表明,此猜想不成立。支持该结论的实验现象是:通入O2后,_______。
Ⅱ.乙同学向pH=10的KOH溶液(含淀粉)中滴加碘水,溶液先变蓝后迅速褪色.经检测褪色后的溶液中含有IO3-,褪色的原因是(用离子方程式表示)____________。
(5)该小组同学对实验过程进行了整体反思.推测实验①的现象产生的原因可能是______;实验⑥的现象产生的原因可能是_______。
查看答案和解析>>
科目: 来源: 题型:
【题目】反应 3A(g)+2B(g)![]() xC(g)+2D(g)过程中的能量变化如下图所示,回答下列问题。
xC(g)+2D(g)过程中的能量变化如下图所示,回答下列问题。
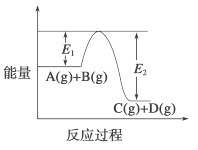
(1)当反应达到平衡时,升高温度,A 的转化率______(填“增大”“减小”或 “不变”),原因是______;
(2)反应体系中加入催化剂对反应热是否有影响?__________,若升高温度反应速率增大, E1的变化是: E1_________。(填“增大”“减小”或“不变”)。
(3)在一定条件下,将 2 mol A 和 2 mol B 混合于容积为2 L的密闭容器中,发生如下反应:3A(g)+B(g)![]() xC(g)+ 2D(g)。2 min末反应达到平衡状态时,生成0.8 mol D,同时测得C的浓度为0.4 mol/L。则此时的平衡常数为________;如果增大体系的压强,则平衡体系中C的体积分数将______(填“增大”“减小”或“不 变”);如果上述反应在相同条件下从逆反应开始进行,起始时加入C和D各4/3mol,要使平衡时各物质的体积分数与原平衡时完全相同,则还应加入______(填“A、B、C、D”)物质_______mol 。
xC(g)+ 2D(g)。2 min末反应达到平衡状态时,生成0.8 mol D,同时测得C的浓度为0.4 mol/L。则此时的平衡常数为________;如果增大体系的压强,则平衡体系中C的体积分数将______(填“增大”“减小”或“不 变”);如果上述反应在相同条件下从逆反应开始进行,起始时加入C和D各4/3mol,要使平衡时各物质的体积分数与原平衡时完全相同,则还应加入______(填“A、B、C、D”)物质_______mol 。
查看答案和解析>>
科目: 来源: 题型:
【题目】下列说法正确的是
A.一氯代烷烃,随C原子数的增多,密度依次增大
B.常压下,正戊烷、异戊烷、新戊烷的沸点依次增大
C.饱和一元羧酸,随C原子数的增多,酸性逐渐减弱
D.邻-二甲苯、间-二甲苯、对-二甲苯的沸点依次升高
查看答案和解析>>
科目: 来源: 题型:
【题目】下图为元素周期表中前 4 周期的表格。
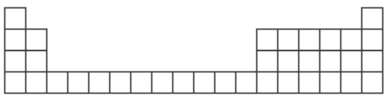
甲是一种常见化合物,其化学式为 XC13。
(1)根据你所学知识,将 X 代表的元素符号,填在所给周期表的表格中对应的位置__________(只写出2 种即可)
(2)若将一种XC13水溶液蒸干、灼烧,得到红棕色粉末 X2O3,则含碳的 X 合金在潮湿的(中性环境)空气中发生电化腐蚀时的正极反应式为__________。
(3)若 X代表另一种金属单质,该单质可与(2)中所述的粉末发生反应,该反应可用于_____。(写出一种用途);该元素的硫酸盐(约1 mol·L-1)和NaHCO3溶液(约1 mol·L-1)及起泡剂制成泡沫灭火剂。使用时发生的化学反应方程式是_______________________________,二者的体积比约是________。泡沫灭火器内的玻璃筒里盛 X 元素的硫酸盐溶液,为什么不能把它盛放在铁筒里________(用离子方程式解释)
查看答案和解析>>
科目: 来源: 题型:
【题目】下列说法正确的是
A. Na与H2O的反应是熵增的放热反应,该反应能自发进行
B. 放热反应的反应速率总是大于吸热反应的反应速率
C. 需要加热的反应一定是吸热反应,常温下能发生的反应一定是放热反应
D. 强电解质溶液导电能力一定很强,弱电解质溶液导电能力一定很弱
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com