
科目: 来源: 题型:
【题目】下列关于CH4和CO2的说法正确的是
A. 固态CO2属于原子晶体
B. CH4分子中含有极性共价键,是极性分子
C. 因为碳氢键键能小于碳氧键,所以CH4熔点低于CO2
D. CH4和CO2分子中碳原子的杂化类型分别是sp3和sp
查看答案和解析>>
科目: 来源: 题型:
【题目】碲(Te)的单质和化合物在化工生产等方面具有重要应用。
(1)下列关于碲及其化合物的叙述不正确的是_______。
A.Te位于元素周期表的第五周期ⅣA族
B. Te的氧化物通常有TeO2和TeO3
C. H2TeO4的酸性比H2SO4酸性强
D.热稳定性H2Te比H2S弱,H2Te比HI强
(2)25℃时,亚碲酸(H2TeO3)的 ![]() = 1×10-3,
= 1×10-3, ![]() =2×10-8。0. 1 mol . L-1H2TeO3 的电离度 a 约为___________ (
=2×10-8。0. 1 mol . L-1H2TeO3 的电离度 a 约为___________ (![]() ); NaHTeO3的溶液的pH_______7(填“>”、“=”或“<”)。
); NaHTeO3的溶液的pH_______7(填“>”、“=”或“<”)。
(3)TeO2微溶于水,易溶于较浓的强酸和强碱。工业上常用铜阳极泥(主要含有TeO2、少量Ag、Au)为原料制备单质碲,其工艺流程如下:
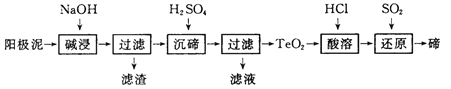
①“碱浸”时TeO2发生反应的化学方程式为 _________。
②“沉碲”时控制溶液的pH为4. 5~5. 0,生成Tea沉淀。酸性不能过强的原因是_________;防止局部酸度过大的操作方法是____________。
③“酸溶”后,将SO2通入TeCl4酸性溶液中进行“还原”得到碲,该反应的化学方程式是____________。
④工业上还可以通过电解铜阳极泥碱浸、过滤后的滤液得到单质碲。已知电解时的电极均为石墨,则阴极的电极反应式为__________。
查看答案和解析>>
科目: 来源: 题型:
【题目】科学家提出“绿色自由”构想,把空气中的CO2转化为可再生能源甲醇(CH3OH)。该反应的热化学方程式为:CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g) △H
CH3OH(g)+H2O(g) △H
(1)若在一个定温定容的容器中发生上述反应,反应达到平衡的标志是________。
A.CO2和CH3OH的浓度相等
B.H2的百分含量保持不变
C.容器内压强保持不变
D.3v正(H2)=v逆(H2O)
E.容器中混合气体的密度保持不变
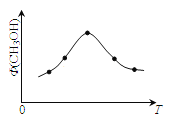
(2)若将CO2和H2的混合气体分成五等份,将它们分别充入温度不同、容积相同的恒容容器中发生上述反应。反应相同时间后,测得甲醇的体积分数 (CH3OH)与反应温度T的关系如图,则上述CO2转化为甲醇的反应的△H_____0(填“>”、“<”、“=”)
(3)上述反应在实际生产中采用的温度是300℃,其目的是_________________。
(4)300℃时,将CO2与H2按1∶3的体积比充入某密闭容器中,CO2的平衡转化率(a)与体系总压强(P)的关系如图所示。回答问题:
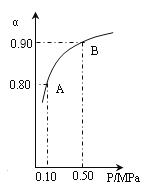
①若其他条件不变,将A点的体积压缩至原来的一半,一段时间后反应再次达到平衡,与原平衡相比较下列说法正确的是_______。
A.CO2的浓度减小 B.正反应速率增大,逆反应速率减小
C.CO2和H2的体积比仍然是1∶3 D.H2的体积分数减小
②B点平衡混合气体的平均摩尔质量为_______________(保留一位小数)。
查看答案和解析>>
科目: 来源: 题型:
【题目】“绿色、高效”概括了2005年诺贝尔化学奖的特点。换位合成法在化学工业中每天都在应用,主要用于研制新型药物和合成先进的塑料材料。在“绿色化学工艺”中,理想状态是反应物中的原子全部转化为欲制得的产物,即原子利用率为100%。①置换反应 ②化合反应 ③分解反应 ④取代反应 ⑤加成反应⑥消去反应 ⑦加聚反应 ⑧缩聚反应等反应类型中能体现这一原子最经济原则的是( )
A.①②⑤ B.②⑤⑦C.⑦⑧D.⑦
查看答案和解析>>
科目: 来源: 题型:
【题目】已知下列两个热化学方程式:
H2(g) + 1/2 O2(g) ![]() H2O(l) △H=-300KJ·mol-1
H2O(l) △H=-300KJ·mol-1
C3H8(g) + 5O2(g) ![]() 3CO2(g) + 4H2O(l) △H =-2000.0 KJ·mol-1
3CO2(g) + 4H2O(l) △H =-2000.0 KJ·mol-1
实验测得氢气的丙烷的混合气体共5mol,完全燃烧时放热5000KJ,则混合气体中氢气和丙烷的体积比约为( )
A. 7:10 B. 3:1 C. 10:7 D. 1:3
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com