
科目: 来源: 题型:
【题目】下列图示与对应的叙述不相符的是( )

A.图1表示KNO3的溶解度曲线,图中a点所示的溶液是80℃时KNO3的不饱和溶液
B.图2表示某放热反应分别在有、无催化剂的情况下反应过程中的能量变化
C.图3表示0.1000molL-1NaOH溶液滴定20.00mL0.1000molL-1醋酸溶液得到滴定曲线
D.图4 表示向NH4Al(SO4)2溶液中逐滴滴入Ba(OH)2溶液,随着Ba(OH)2溶液体积V的变化,沉淀总物质的量n的变化
查看答案和解析>>
科目: 来源: 题型:
【题目】可用于除去乙烷中的乙烯以得到乙烷的方法是( )
A. 通过足量的氢氧化钠溶液
B. 通过足量的溴水
C. 通过足量的酸性高锰酸钾溶液
D. 通过足量的浓盐酸
查看答案和解析>>
科目: 来源: 题型:
【题目】氨气是一种重要的化工产品,有广泛用途,工业上可以由氢气和氮气合成。
(1)已知键能:N![]() N 945kJ·mol-1,H-H 436 kJ·mol-1,N-H 391kJ·mol-1。
N 945kJ·mol-1,H-H 436 kJ·mol-1,N-H 391kJ·mol-1。
①氮气、氢气合成氨的热化学方程式是______________。
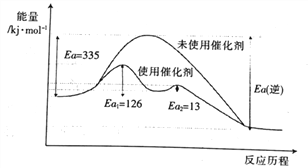
②未使用催化剂时,逆反应的活化能Ea(逆)=______ kJ·mol-1;使用催化剂之后正反应的总活化能为_______ kJ·mol-1。
(2)下表是当反应器中按n(N2):n(H2)=l:3投料后,在200℃、400℃、600℃,反应达到平衡时,混合物中NH3的物质的量分数随总压强的变化曲线。
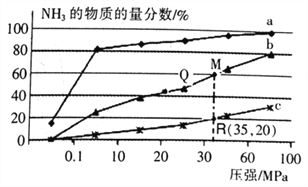
①曲线a、b对应温度较高的是________ (填“a”或“b”)
②实验室模拟工业合成氨,一定温度和压强下在1L密闭容器中通入5 mol N2、15molH2,10min 后达到M点平衡状态,计算从反应开始至平衡时间段内的平均速率V(N2)___mol·L-1·min-1。
③关于工业合成氨的反应,下列叙述正确的是_______(填字母)。
A.分离出NH3后的原料气循环利用,可以提高H2的平衡转化率
B.使州催化剂能加快反应速率且提高H2的平衡转化率
C.上图中M、Q、R点平衡常数K的大小关系是K(M)= K(Q)> K(R)
④列出R点平衡常数的计算式Kp=____(MPa)-2。(用平衡分压代替平衡浓度计箅,分压=总压×物质的量分数。不要求计算结果)
查看答案和解析>>
科目: 来源: 题型:
【题目】下列既属于放热反应又属于氧化还原反应的是
A. 氧化钙与水反应B. 铁丝在氧气中燃烧
C. NaOH溶液与盐酸反应D. Ba(OH)2·8H2O晶体与NH4Cl晶体反应
查看答案和解析>>
科目: 来源: 题型:
【题目】呋喃类化合物是重要的有机合成中间体。下面是某研究小组合成呋喃类化合物的路线:
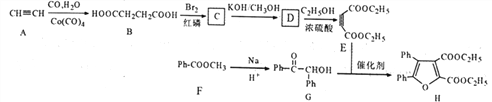
己知:①ph—为苯环
② 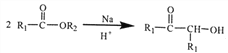
回答下列问题:
(1)下列能用于测定H结构的仪器有___________ 。(填序号)
a.核磁共振仪 b.红外光谱仪 c.质谱仪
(2)G中官能团名称为__________。
(3)E的化学名称是_______,B生成C的反应类型为_______________。
(4)写出由D生成E的化学方程式为___________________。
(5)含有羧基和两个苯环,且两个苯环不直接相连的G的同分异构体共有_____种(不含立体
结构),其中核磁共振氢谱显示为5组峰,峰面积比为4:4:2:1:1的是_____(写结构简式)。
(6)参照上述合成路线,以E和乙醇为原料(无机试剂任选),设计制备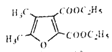 合成路线_______________________。
合成路线_______________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】意大利罗马大学的Fulvio Cacace等人获得了极具理论研究意义的N4分子。N4分子结构如下图所示,已知断裂1mol N—N键吸收167kJ热量,生成1mol N≡N放出942kJ热量,根据以上信息和数据,下列说法正确的是
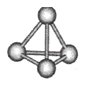
A. N4属于一种新型的化合物
B. N4与N2互为同素异形体
C. N4沸点比P4(白磷)高
D. 1molN4气体转变为N2将吸收882kJ热量
查看答案和解析>>
科目: 来源: 题型:
【题目】糠酸又称呋喃甲酸,在食品工业作防腐剂,还可用于合成树脂或医药、香料等的中 间体。以米槺或玉米芯提取的呋喃甲醛为原料合成糠酸反应如下
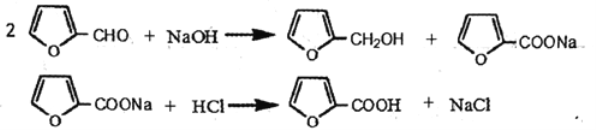
几种有机物性质如下:
名称 | 性状 | 相对分 子质量 | 溶解度 | |||
冷水 | 热水 | 乙醇 | 乙醚 | |||
呋喃甲醛 | 无色液体 | 96 | 微溶 | 易溶 | 易溶 | 互溶 |
呋喃甲醇 | 无色液体 | 98 | 互溶 | 互溶 | 易溶 | 易溶 |
呋喃甲酸 | 无色晶体 | 112 | 微溶 | 易溶 | 可溶 | 易溶 |
刚果红试纸pH变色范围:3.0(蓝紫色)~5.0(红色)
呋喃甲酸的实验室制备方法如下:
三颈瓶中放人3.28mL(0.04mol)新蒸呋喃甲醛,控温8~12℃下滴加4mL40%NaOH溶液,并
磁力搅拌回流30分钟。向反应混合物滴加蒸馏水(约15mL)使其恰好澄清,用50mL乙醚萃取分液,其水溶液用水蒸气蒸馏,弃去镏出物,慢慢滴加2:1盐酸到pH=3,搅拌,析出结晶,抽滤并用少量水洗涤抽干,得精产品1.75g。
回答以下问题:
(1) 三颈瓶中反应需要搅拌回流30分钟的原因是__________。
(2) 呋喃甲醛在碱中反应大量放热,实验中需要控温8-12℃,其操作方法_________。
(3)50mL乙醚萃取分液,除去呋喃甲醇的操作方法是____________。
A、 直接用50mL乙醚萃取分液
B、 将溶液分两份,乙醚也分两份,分别萃取,萃取液合并
C、 先用30mL乙醚萃取分液,再分别州l0mL乙醚萃取两次,并将三次萃取液合并
(4)乙醚提取后的水溶液要用盐酸酸化。配制100mL 2:1稀盐酸(水与盐酸体积比)的方法是___________;判断盐酸加入足量的方法是________________。
(5)乙醚易挥发、易燃,蒸气可使人失去知觉,在蒸馏回收乙醚时注意:_____________;水蒸气蒸馏的方法应选择________(填字母序号);
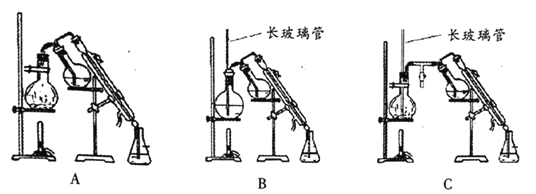
(6)算呋喃甲酸的产率___________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】由2-溴丙烷为主要原料制取1,2-丙二醇时,需要经过的反应类型是:( )
A. 加成—消去—取代B. 消去—加成—取代
C. 取代—消去—加成D. 取代—加成—消去
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com