
【题目】由2-溴丙烷为主要原料制取1,2-丙二醇时,需要经过的反应类型是:( )
A. 加成—消去—取代B. 消去—加成—取代
C. 取代—消去—加成D. 取代—加成—消去
 导学全程练创优训练系列答案
导学全程练创优训练系列答案科目:高中化学 来源: 题型:
【题目】胡炳成教授团队经过多年的刻苦钻研,通过氧化断裂的方式选择性地切断芳基五唑分子中 的C-N键(如图)首次制得室温下稳定的含能材料(N5)6(H3O)3(NH4)4Cl(PHAC),热分析结果显示PHAC分解温度高达116.8℃,具有非常好的热稳定性。
下列说法错误的是

A. 反应表明拆开N-C键比N-N键容易 B. ![]() 属于芳香醇的异构体有5种
属于芳香醇的异构体有5种
C. PHAC是一种酸式盐 D. PHAC能用于制造高能炸药
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】通常人们把拆开1mol某化学键所消耗的能量看成该化学键的键能。键能的大小可以衡量化学键的强弱,也可用于估算化学反应的反应热。
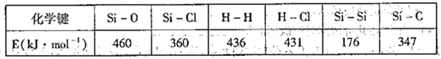
工业上高纯硅可通过下列反制取:SiCl4(g) +2H2(g)= Si(g) +4HCl(g),(已知 lmol晶体Si中2molSi -Si键),该反应产生的热量为
A. 吸收45kJ mo1-1 B. 放出412 kJ mo1-1
C. 吸收 236 kJ mo1-1 D. 放出236 kJ mo1-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】地壳中含量占第一、二位的元素之间形成的化合物不具有的性质是( )
A. 常温下与水反应生成酸 B. 高温时能与CaO、CaCO3反应
C. 常温下能与苛性钠反应 D. 常温时能与氢氟酸反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氨气是一种重要的化工产品,有广泛用途,工业上可以由氢气和氮气合成。
(1)已知键能:N![]() N 945kJ·mol-1,H-H 436 kJ·mol-1,N-H 391kJ·mol-1。
N 945kJ·mol-1,H-H 436 kJ·mol-1,N-H 391kJ·mol-1。
①氮气、氢气合成氨的热化学方程式是______________。
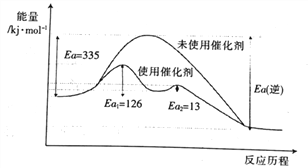
②未使用催化剂时,逆反应的活化能Ea(逆)=______ kJ·mol-1;使用催化剂之后正反应的总活化能为_______ kJ·mol-1。
(2)下表是当反应器中按n(N2):n(H2)=l:3投料后,在200℃、400℃、600℃,反应达到平衡时,混合物中NH3的物质的量分数随总压强的变化曲线。
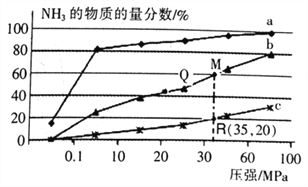
①曲线a、b对应温度较高的是________ (填“a”或“b”)
②实验室模拟工业合成氨,一定温度和压强下在1L密闭容器中通入5 mol N2、15molH2,10min 后达到M点平衡状态,计算从反应开始至平衡时间段内的平均速率V(N2)___mol·L-1·min-1。
③关于工业合成氨的反应,下列叙述正确的是_______(填字母)。
A.分离出NH3后的原料气循环利用,可以提高H2的平衡转化率
B.使州催化剂能加快反应速率且提高H2的平衡转化率
C.上图中M、Q、R点平衡常数K的大小关系是K(M)= K(Q)> K(R)
④列出R点平衡常数的计算式Kp=____(MPa)-2。(用平衡分压代替平衡浓度计箅,分压=总压×物质的量分数。不要求计算结果)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】清华大学科学家将古老的养蚕技术与碳纳米管和石墨烯结合,获得了更加牢固的蚕丝纤维,其延展性、抗拉强度显著提高,通过高温加热碳化还可显著提高导电性。下列有关说法正确的是
A. 石墨烯具有良好的导电性能,所以石墨烯基锂电池具有独特优势
B. 蚕丝纤维属于纯净物
C. 石墨烯属于烯烃
D. 蚕丝纤维加热碳化后具有导电性是因为所有碳单质都具有良好的导电性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】海水是巨大的资源宝库。下图是人类从海水资源获取某些重要化工原料的流程示意图。

回答下列问题:
(1)操作A是 ______________(填实验基本操作名称)。
(2)操作B需加入下列试剂中的一种,最合适的是_________。
a.氢氧化钠溶液 b.澄清石灰水 c.石灰乳 d.碳酸钠溶液
(3)工业上制取金属镁时是电解熔MgCl2电解反应方程式为_________。
(4)上图中虚线框内流程的主要作用是____________。写出溴水中通入S02时反应的离子方程式___________。
(5)上图中虚线框内流程也可用![]() 替代,请写出Br2与Na203反应(其中一种产物为NaBr03)的化学方程式__________。
替代,请写出Br2与Na203反应(其中一种产物为NaBr03)的化学方程式__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氢化铝钠(NaAlH4)是一种新型轻质储氢材料,掺入少量Ti的NaAlH4在150℃时释氢,在170℃、15.2 MPa条件下又重复吸氢。NaAlH4可由AlCl3和NaH在适当条件下合成。NaAlH4的晶胞结构如图所示。

(1)基态Ti原子的价电子排布式为___________。
(2)NaH的熔点为800℃,不溶于有机溶剂。NaH属于_____晶体,其电子式为______。
(3)AlCl3在178℃时升华,其蒸气的相对分子质量约为267,蒸气分子的结构式为____(标明配位键)。
(4)AlH4-中,Al的轨道杂化方式为_____;列举与AlH4-空间构型相同的两种离子:_____(填化学式)。
(5)NaAlH4晶体中,与Na+紧邻且等距的AlH4-有_____个;NaAlH4晶体的密度为____g/cm3(用含a 的代数式表示)。
(6)NaAlH4的释氢机理为:每3个AlH4-不中,有2个分别释放出3个H原子和1个Al原子,同时与该Al原子最近的Na原子转移到被释放的Al原子留下的空位,形成新的结构。这种结构变化由表面层扩展到整个晶体,从而释放出氢气。该释氢过程可用化学方程式表示为___________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com