
科目: 来源: 题型:
【题目】下列关于晶体的叙述错误的是
A.在金刚石网状结构中,由共价键形成的最小碳环上有6个碳原子
B.在氯化钠晶体中,每个钠离子的周围与它最近且等距离的钠离子有12个
C.在干冰晶体中,每个二氧化碳分子周围距离最近且相等的二氧化碳分子数是12
D.在氯化铯的晶体中,每个铯离子的周围与它最近且等距离的铯离子有8个
查看答案和解析>>
科目: 来源: 题型:
【题目】CaC2晶体的晶胞结构与NaCl晶体的相似(如图所示),但CaC2晶体中由于哑铃形的C22-存在,使晶胞沿一个方向拉长。下列关于CaC2晶体的说法中正确的是( )

A.1 个 Ca2+周围距离最近且等距离的 C22-数目为 6
B.该晶体中的阴离子与F2是等电子体
C.6.4 g CaC2晶体中含阴离子0.1 mol
D.与每个Ca2+距离相等且最近的Ca2+共有12个
查看答案和解析>>
科目: 来源: 题型:
【题目】2008年北京奥运会主体育场——“鸟巢”,被《泰晤士报》评为全球“最强悍”工程。“鸟巢”运用了高强度、高性能的钒氮合金高新钢和884块ETFE膜,并采用新一代的氮化镓铟高亮度LED材料。有关说法正确的是

A. 合金的熔点通常比组分金属高,硬度比组分金属小
B. 已知Ga处于ⅢA主族,可推知氮化镓化学式为Ga3N2
C. 用金属铝与V2O5反应冶炼钒,铝作还原剂
D. V原子序数为23,该原子的价电子构型为4S24P1
查看答案和解析>>
科目: 来源: 题型:
【题目】M元素的一个原子失去两个电子转移到R元素的两个原子中去,形成离子化合物。下列四种化合物都符合条件,但从结构上看,有一种物质与其它三种明显不同,该物质是( )
A. FeS2 B. CaC2 C. BaO2 D. MgCl2
查看答案和解析>>
科目: 来源: 题型:
【题目】用下列实验装置进行相应的实验,不能达到实验目的是( )
A | B | C | D | |
装置 |
|
|
|
|
实验 | 结合秒表定量比较锌与不同浓度的稀硫酸反应的快慢 | 证明温度对化学平衡的影响 | 验证铁钉发生吸氧腐蚀 | 可证明非金属性 C>Si |
A. A B. B C. C D. D
查看答案和解析>>
科目: 来源: 题型:
【题目】前四周期原子序数依次增大的六种元素A、B、C、D、E、F中,A、B属于同一短周期且相邻的元素,B基态原子2p轨道中有三个自旋方向完全相同的电子;C基态原子核外电子占有9个轨道,且只有1个未成对电子;D、E、F是位于同一周期的金属元素, D、E基态原子的价电子层中未成对电子数分别为4、2,且原子序数相差2;F是ds区元素,F基态原子的价电子层中只有1个未成对电子。
回答下列问题:
(1)E元素在周期表中的位置是____________,E的价层电子排布图为________________。E单质能导电的原因是_______________。
(2)A、B、D三种元素形成配合物D3[D(AB)6]2,该配合物的中心离子是___,1 个AB-离子中含有_____个 π键。
(3)A元素最高价氧化物分子中A原子的杂化轨道类型是______,BC3分子的立体构型是_____________。
(4)新制的F(OH)2能够溶解于浓NaOH溶液中形成一种配离子,反应的离子方程式是__。
(5)E、F元素的第二电离能分别是:IE=1753kJ/mol、IF=1958kJ/mol, IF>IE的原因是___。
(6)C、F元素形成的一种化合物晶胞如下图,F位于面心和顶点,其晶胞参数为a pm。
①已知M点的坐标为![]() ,则N点的坐标为______,P点的坐标为_______。
,则N点的坐标为______,P点的坐标为_______。
若阿伏加德罗常数用NA表示,则该晶体的密度是_____________g/cm3(只要求列算式)。
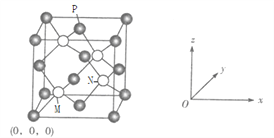
查看答案和解析>>
科目: 来源: 题型:
【题目】下列有关电化学装置的叙述正确的是 ( )

A. 图1中,Zn—MnO2干电池放电时,MnO2被氧化
B. 图2中,电解精炼铜时,阳极减少的质量与阴极增加的质量一定相等
C. 图4中,在钢材上电镀铝,熔融盐中Al和Cl元素只以AlCl4-、Al2Cl7-形式存在,则阳极反应式为:Al -3e-+7AlCl4-=4Al2Cl7-
D. 图3中,K分别与M、N连接,均可保护Fe电极,连接M时称为“牺牲阳极的阴极保护法”
查看答案和解析>>
科目: 来源: 题型:
【题目】分某化学兴趣小组在实脸室模拟侯德榜制碱法制备纯碱。主要步骤如下:
第一步:配制饱和NaCl溶液,倒入烧杯中加热;
第一步:控制温度在30-35 ℃。边搅拌边分批加入研细的NH4HCO3固体,加料完毕后,继续保温30分钟;
第三步:静置、过滤得NaHCO3晶体.用少量蒸馏水洗涤除去杂质,然后抽干;
第四步:将第二步所得固体转入蒸发皿中,灼烧2小时,制得纯碱固体,
已知:温度高于35℃时,NH4HCO3会分解。有关盐的溶解度(g/100g水)如下表:
盐 | 0℃ | 10℃ | 20℃ | 30℃ | 40℃ | 50℃ | 60℃ | 100℃ |
NaCl | 35.7 | 35.8 | 36.0 | 36.3 | 36.6 | 37.0 | 37.3 | 39.8 |
NH4HCO3 | 11.9 | 15.8 | 21.0 | 27.0 | —— | —— | —— | —— |
NaHCO3 | 6.9 | 8.1 | 9.6 | 11.l | 12.7 | 14.5 | 16.4 | —— |
NH4Cl | 29.4 | 33.3 | 37.2 | 41.4 | 45.8 | 50.4 | 55.3 | 77.3 |
回答下列问题:
(1)反应温度控制在30-35℃范围内,应采取的加热方法为 ,反应温度不能高于35℃的理由是 .
(2)第三步静置后析出NaHCO3晶体的原因是 ;用蒸馏水洗涤NaHCO3晶体的目的是除去杂质粒子 (用离子符号表示)。
(3)若向过滤所得母液中加入 (填写试剂名称),并作进一步处理,使NaCl溶液循环使用,同时可回收NH4Cl。
(4)纯碱产品不纯,含有NaHCO3、NaCl等杂质。测定纯碱中NaHCO3含量的方法是:准确称取纯碱样品Wg,放入锥形瓶中加蒸馏水溶解,加l-2滴酚酞指示剂,用物质的量浓度为cmol/L的盐酸滴定至溶液由红色到无色(指示CO32-+H+=HCO3-反应的终点), 所用盐酸体积为V1mL,再加1-2滴甲基橙指示剂,继续用盐酸滴定至溶液由黄变橙,所用盐酸总体积为V2mL。
① 实验室配制一定体积cmol/L盐酸需用的仪器除了容量瓶、烧杯、量筒外还需 ;在容量瓶的使用方法中,下列操作正确的是 (填写标号)
a.使用容量瓶前检验它是否漏水
b.容量瓶用蒸馏水洗净后,再用待配溶液润洗
c.配制溶液时,如果试样是固体,把称好的试样用纸条小心倒入容量瓶中.然后加蒸馏水定容
d.用容量瓶把溶液配制完成以后.直接贴上标签,放置备用
e.定容后盖好瓶塞,用食指顶住瓶塞,用另一只手指托住瓶底,把容量瓶倒转和摇动几次
② 写出纯碱样品中NaHCO3质量分数的计算式:NaHCO3(%)= 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com