
科目: 来源: 题型:
【题目】某学习小组分析实验室制氯气的方法后认为:MnO2与FeCl3·6H2O共热能产生Cl2,于是设计了下列装置验证该结论。
【查阅资料】FeCl3·6H2O是棕黄色晶体,熔点37℃,沸点280~285℃。
【实验设计】
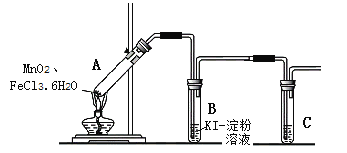
若结论成立,B中发生反应的化学方程式是___,C中的试剂是___。
【实验过程】
操作 | 现象 |
(1)经检查,装置气密性良好。 (2)添加药品,连接装置。 (3)点燃酒精灯。 | i.A中部分固体熔化,上方出现白雾; ii.稍后,产生黄色气体,管壁附着黄色液滴; iii.B中溶液变蓝。 |
【实验分析】
(1)小组讨论一致认为现象i中的白雾是盐酸小液滴,产生白雾的原因是___。
(2)分析现象ii时发生了分歧,有同学认为:FeCl3·6H2O是棕黄色,沸点不高,黄色气体重含有FeCl3也会导致B中溶液变蓝,反应的离子方程式是___。
小组同学通过下列实验证明现象ii的黄色气体中含有Fe3+,将下列实验补充完整:
a.只在A中加入FeCl3·6H2O,加热,开始产生白雾,稍后出现黄色气体,管壁仍有黄色液滴。
b.____________________________________ ,溶液变红。
(3)为进一步确认黄色气体含有 Cl2,小组在A、B 间增加盛有饱和氯化钠溶液的试管,气体依次通过饱和氯化钠溶液、KI淀粉溶液后,KI淀粉溶液变蓝,证实黄色气体中含有Cl2。饱和氯化钠溶液的主要作用是___。
(4)A中固体充分加热后得到Fe2O3和MnCl2,若物质的量之比为1:1,则A中总反应的化学方程式是________。从混合物中分离出Fe2O3的方法是:___。
【安全预案】在实验过程中,若试管B中溶液已经开始发生倒吸,应立即采取的一种措施是___ (填写编号)。
a.移去酒精灯
b.取下B中盛有溶液的试管
c.将A、B间的导管从乳胶管中取出
查看答案和解析>>
科目: 来源: 题型:
【题目】工业上以铬铁矿(含有Cr2O3,FeO、Al2O3、SiO2等成分)为主要原料生产重铬酸钠晶体(Na2Cr2O7·2H2O),其主要工艺流程如下:
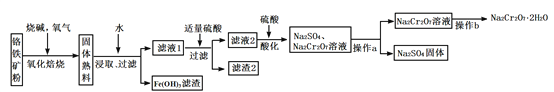
提示:熟料中含有Na2CrO4、NaFeO2等成分。
回答下列问题:
(1)将铬铁矿粉碎的目的是_____________________________ 。
(2)氧化焙烧时,生成Na2CrO4的化学方程式是__________。
(3)滤渣2中除Al(OH)3外还有__________(填化学式)。
(4)加入硫酸酸化的目的是__________________________。
(5)根据下图,请将操作a补充完整:________________,洗涤,干燥。
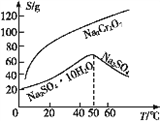
(6)控制105~110℃,向较浓的Na2Cr2O7溶液中加入KCl固体发生复分解反应,立即析出K2Cr2O7晶体。能生成K2Cr2O7晶体的原因是_____________。
(7)向Na2Cr2O7酸性溶液中加入过量FeSO4溶液,生成Cr3+和 Fe3+,再加入过量的强碱溶液生成铁铬氧体沉淀(CrxFe3-xO4)。加入过量强碱生成铁铬氧体沉淀的离子方程式是______。
查看答案和解析>>
科目: 来源: 题型:
【题目】煤燃烧的烟气中含有SO2和NO,直接排放会形成酸雨、污染大气,因此对烟气进行脱硫、脱硝具有重要意义。
(1)选择性催化还原技术是目前成熟的烟气脱硝技术,即在金属催化剂作用下,用还原剂(如NH3)选择性地与NO反应生成N2和H2O。
①已知:4NH3(g) + 5O2(g) ![]() 4NO(g) + 6H2O(g) ΔH = -905.5kJ/mol
4NO(g) + 6H2O(g) ΔH = -905.5kJ/mol
N2(g) + O2(g) ![]() 2NO(g) ΔH =+180 kJ/mol
2NO(g) ΔH =+180 kJ/mol
则该方法中主要反应的热化学方程式是(请补充完整):
4NH3(g) + 4NO(g) + O2(g)![]() 4N2(g) + 6H2O(g) ΔH =_________
4N2(g) + 6H2O(g) ΔH =_________
②该方法控制反应温度在315~400℃之间,反应不宜过低也不能过高的原因是_________。
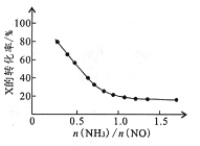
③氨氮比[n(NH3)/n(NO)]的大小会影响该方法的脱硝率。350℃时,只改变NH3的投放量,反应物X的转化率与氨氮比的关系如右图,则X是_____(填化学式)。氨氮比由0.5增加到1.0时,脱硝主要反应的平衡将向____________方向移动。当氨氮比大于1.0时,烟气中NO浓度反而增大,主要原因是___________。
(2)将烟气中的SO2、NO经O3处理后,再用CaSO3悬浊液吸收,可脱硫、脱硝。
已知:O3氧化烟气中SO2、NO的主要反应为:
NO + O3![]() NO2 + O2; 2NO + O2
NO2 + O2; 2NO + O2![]() 2NO2; SO2+ O3
2NO2; SO2+ O3![]() SO3 + O2
SO3 + O2
用CaSO3悬浊液(pH=8)吸收经O3处理后的烟气时,NO2转化为NO2-,离子方程式为
_____________。
② 在CaSO3悬浊液中加入Na2SO4溶液可提高NO2的吸收速率,请结合化学原理进行解释___________________________。
③烟气经处理后最终得到含Na+、NO2-、SO42-的吸收液。t℃时,向吸收液中加入AgNO3溶液至SO42-恰好完全沉淀(即SO42-浓度等于1.0×10-5 mol·L-1)时,c(NO2-)=_______mol/L。[t℃时,AgNO2(亚硝酸银)的 Ksp= 9.0×10-4、Ag2SO4的Ksp=4.0×10-5。]
查看答案和解析>>
科目: 来源: 题型:
【题目】二氧化氯(ClO2)是极易溶于水且不与水发生化学反应的黄绿色气体,沸点为11℃,可用于处理含硫废水。某小组在实验室中探究ClO2与Na2S的反应。回答下列问题:
(l)ClO2的制备:(已知:SO2+2NaClO3+H2SO4=2ClO2↑+2NaHSO4)

①装置A中反应的化学方程式为_______________。
②欲收集干燥的ClO2,选择上图中的装置,其连接顺序为 a→_________(按气流方向,用小写字母表示)
③装置D的作用是_________。
(2)ClO2与 Na2S 的反应
将上述收集到的ClO2用 N2稀释以增强其稳定性,并将适量的稀释后的ClO2通入上图所示装置中充分反应,得到无色澄清溶液。一段时间后,通过下列实验探究 I 中反应的产物。

操作步骤 | 实验现象 | 结论 |
取少量Ⅰ中溶液于试管甲中, 加入Ba(OH)2溶液,振荡 | ①_________ | 有硫酸根离子生成 |
另取少量Ⅰ中溶液于试管乙中, 滴加品红溶液和盐酸 | 品红溶液不翅色 | ② 无_____生成 |
若在试管甲中继续加Ba(OH)2溶液至 过量,静置,取上层清液于试管丙③______ | 有白色沉淀生成 | 有Cl-生成 |
④ClO2与Na2S反应的离子方程式为__________。用于处理含硫废水时,ClO2相对于Cl2的优点是____________(任写2条)。
查看答案和解析>>
科目: 来源: 题型:
【题目】〔化学——选修3:物质结构与性质〕举世瞩目的中国探月工程三期再入返回试验器于2014年10月24日凌晨成功发射,为实现月球采样和首次地月往返踏出了成功的第一步。探月工程三期的主要目标是实现无人自动采样返回,突破月面采样、月面上升、月球轨道交会对接等核心关键技术。已知所用火箭推进剂为肼(N2H4)和过氧化氢(H2O2),火箭箭体一般采用钛合金材料。
请回答下列问题:
(1)N2H4、H2O2分子中电负性最大的元素在周期表中的位置为 ,第一电离能最大的元素为 。
(2)钛的原子序数为22,其基态电子排布式示意图为 。
(3)1 mol N2H4分子中含有的键数目为 。
(4)H2O2分子结构如图1,其中心原子杂化轨道为 ,估计它难溶于CS2,简要说明原因 。
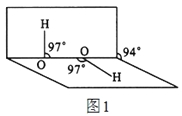
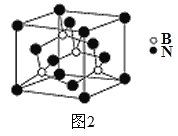
(5)氮化硼其晶胞如图2所示,则处于晶胞顶点上的原子的配位数为 ,若立方氮化硼的密度为g·cm-3,阿伏加德罗常数为NA,则两个最近N原子间的距离为________cm。
查看答案和解析>>
科目: 来源: 题型:
【题目】下列关于CaF2的表述正确的是
A. Ca2+与F-间仅存在静电吸引作用
B. F-的离子半径小于Cl-,则CaF2的熔点高于CaCl2
C. 阴阳离子比为2:1的物质,均与CaF2晶体构型相同
D. CaF2中的化学键为离子键,因此CaF2在晶体状态下能导电
查看答案和解析>>
科目: 来源: 题型:
【题目】氮是动植物生长不可缺少的元素,合成氨的反应对人类解决粮食问题贡献巨大,反应如下:N2(g)+3H2(g)![]() 2NH3(g)
2NH3(g)
合成氨的反应中的能量变化如图所示。
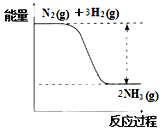
①该反应是___________反应(填“吸热”或“放热”),其原因是反应物化学键断裂吸收的总能量_____(填“大于”或“小于”)生成物化学键形成放出的总能量。
②在一定条件下,将一定量的N2和H2的混合气体充入某定容密闭容器中,一段时间后,下列叙述不能说明该反应达到平衡状态的是___________(填序号)。
A.容器中混合气体的密度不随时间变化
B.单位时间内断裂3 mol H-H键的同时断裂6 mol N-H键
C.N2 、H2 、NH3的物质的量之比为1:3:2
D.容器中混合气体的平均相对分子质量不随时间变化
③一种用于驱动潜艇的液氨-液氧燃料电池原理示意如图:
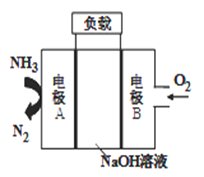
电极A上发生的电极反应为:_____________________。
若电池工作一段时间后,消耗标准状况下的氧气11.2L,则该过程转移电子______mol.
查看答案和解析>>
科目: 来源: 题型:
【题目】巴豆酸的结构简式为CH3—CH=CH—COOH。现有①氯化氢、②溴水、③纯碱溶液、④2丁醇、⑤酸性KMnO4溶液,试根据巴豆酸的结构特点,判断在一定条件下,能与巴豆酸反应的物质是( )
A. 只有②④⑤B. 只有①③④C. ①②③④⑤D. 只有①②③④
查看答案和解析>>
科目: 来源: 题型:
【题目】“低碳循环”引起各国的高度重视,已知煤、甲烷等可以与水蒸气反应生成以CO和H2为主的合成气,合成气有广泛应用.试回答下列问题:
(1)高炉炼铁是CO气体的重要用途之一,其基本反应为:
FeO(s)+CO(g)![]() Fe(s)+CO2(g)△H>0.
Fe(s)+CO2(g)△H>0.
已知在1100°C时,该反应的化学平衡常数K=0.263.
①温度升高,平衡移动后达到新平衡,此时平衡常数值________(填“增大”“减小”“不变”);
②1100°C时测得高炉中,c(CO2)=0.025mol·L﹣1,c(CO)=0.1mol·L﹣1,则在这种情况下,该反应这一时刻向__________进行(填“左”或“右”).
(2)目前工业上也可用CO2来生产燃料甲醇CH3OH,有关反应为:CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g),△H=﹣49.0KJmol﹣1,某温度下,向体积为1L恒容密闭容器中,充入1molCO2和3molH2,反应过程中测得CO2和CH3OH(g)的浓度随时间的变化如图所示.
CH3OH(g)+H2O(g),△H=﹣49.0KJmol﹣1,某温度下,向体积为1L恒容密闭容器中,充入1molCO2和3molH2,反应过程中测得CO2和CH3OH(g)的浓度随时间的变化如图所示.

①反应开始至平衡,氢气的平均反应速率v(H2)=__________,CO2的转化率为_______.
该温度下上述反应的平衡常数K=____________(分数表示).
②反应达到平衡后,下列能使![]() 的值增大的措施是_________(填符号)。
的值增大的措施是_________(填符号)。
a.升高温度 b.再充入H2 c.再充入CO2
d.将H2O(g)从体系中分离 e.充入He(g)
③以8g甲醇为燃料,足量O2为氧化剂,250ml 浓度为1mol/L的KOH溶液为电解质溶液,可制成燃料电池(电极材料为惰性电极).写出燃料电池负极的电极反应式:_________________。
④有人提出,可以设计反应2CO(g)=2C(s)+O2(g)(△H>0)来消除CO的污染。请你判断上述反应是否能自发进行并说明理由__________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】下列有关物质的量的说法中,正确的是
A. Mg的摩尔质量为24 g
B. 物质的量的单位是摩尔
C. 1 mol O2在任何条件下的体积都为22.4 L
D. 将1 mol NaCl晶体加入到1L水中,得到NaCl溶液的浓度就是1 mol L-1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com