
科目: 来源: 题型:
【题目】
G是有机合成的中间体,其合成路线如图所示。

请回答下列问题:
(1)X既能与氯化铁溶液发生显色反应,又能发生银镜反应,且苯环上一氯代物只有2种,X的结构简式为____________。
(2)反应③的类型是________;Y的化学式为_______,Y中含氧官能团的名称是____。
(3)写出步骤④的化学方程式______________。
(4)写出同时满足下列条件的F的所有芳香族同分异构体的结构简式: ______________。
(a)水解产物之一能和氯化铁溶液发生显色反应
(b)能和新制氢氧化铜悬浊液在共热条件下发生反应生成砖红色固体
(c)核磁共振氢谱有4组峰,且峰面积之比为1:2:3:6
(5)上述流程中,步骤③、④能否互换_____(填“能”“否”),简述理由__________。
(6)已知:R1CH =CHR2![]() R1CHO + R2CHO;仿照上述合成路线,设计以苯乙烯为主要原料合成
R1CHO + R2CHO;仿照上述合成路线,设计以苯乙烯为主要原料合成![]() 的路线(无机试剂任选)________________。
的路线(无机试剂任选)________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】下列关于钢铁发生吸氧腐蚀的分析正确的是
A. 吸氧腐蚀是吸热反应 B. 铁作原电池正极
C. 正极电极反应为:2H2O+O2+4e-=4OH- D. 原电池负极反应为:Fe-3e-=Fe3+
查看答案和解析>>
科目: 来源: 题型:
【题目】下列关于纯净物,混合物,强电解质,弱电解质和非电解质的正确组合是
纯净物 | 混合物 | 强电解质 | 弱电解质 | 非电解质 | |
A | 纯盐酸 | 水煤气 | 硫酸 | 醋酸 | 干冰 |
B | 冰醋酸 | 空气 | 硫酸钡 | 亚硫酸 | 二氧化硫 |
C | 氯气 | 盐酸 | 苛性钠 | 氢硫酸 | 碳酸钙 |
D | 漂白粉 | 氨水 | 氯化钠 | 次氯酸 | 氯气 |
A. A B. B C. C D. D
查看答案和解析>>
科目: 来源: 题型:
【题目】甲苯是由苯环和甲基结合而成的,甲苯能够使酸性KMnO4溶液褪色是因为( )
A. 烷烃能使酸性KMnO4溶液褪色 B. 苯环能使KMnO4酸性溶液褪色
C. 甲基使苯环的活性增强而导致的 D. 苯环使甲基的活性增强而导致的
查看答案和解析>>
科目: 来源: 题型:
【题目】根据如图转化回答有关问题:

(1)写出下列反应的化学方程式:
①A、C反应生成乙酸乙酯________________
②A转化为B__________________________
(2)为了制取乙酸乙酯,甲、乙、丙三位同学分别设计下列三套实验装置:

请从甲、乙两位同学设计的装置中选择一种作为实验室制取乙酸乙酯的装置,选择的装置是________(选填“甲”或“乙”),丙同学将甲装置中的玻璃管改成球形干燥管,除起冷凝作用外,另一重要作用是___________________。
(3)试管B中放入的是饱和____________溶液,从试管B中分离出乙酸乙酯所用的主要仪器是__________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】利用海洋资源可以获得很多物质。如从海水中可以得到食盐等许多化工原料,可以通过蒸馏获得淡水,从海洋植物中提取碘等。
(一)从海水得到的粗盐中常含有杂质需要分离提纯,在除去悬浮物和泥沙之后,要用以下试剂①盐酸、②Na2CO3、③NaOH、④BaCl2来除去食盐水中的Ca2+、 Mg2+、SO42-。
(1)为有效除去Ca2+、 Mg2+、SO42-,加入试剂的合理顺序为___________。
a.先加 NaOH,后加Na2CO3,再加 BaCl2
b.先加NaOH,后加BaCl2,再加Na2CO3
C.先加BaCl2,后加NaOH,再加Na2CO3
(2)加入Na2CO3过程中发生反应的离子方程式为_______________________。
(3)判断试剂BaCl2己经足量的方法是_______________________。
(二)海洋植物如海带、海藻中含有丰富的碘元素,碘元素以碘离子的形式存在。实验室里从海带中提取碘的流程如下:
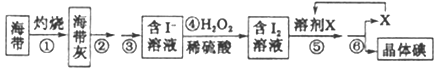
(1)实验时灼烧海带应在___________(填仪器名称)内进行。
(2)步骤④中反应的离子方程式是_______________。
(3)步骤⑤的实验操作为____________,应选用的一种溶剂X可以是____________。
a.苯、酒精 b.四氯化碳、苯 c.汽油、酒精
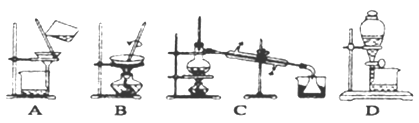
(4)步骤⑥的实验操作应选用下图中的_____________。
查看答案和解析>>
科目: 来源: 题型:
【题目】有下列三种物质①乙醇、②碳酸、③水,它们与钠反应产生氢气的速率由大到小的顺序是( )
A. ①>②>③B. ②>①>③C. ③>①>②D. ②>③>①
查看答案和解析>>
科目: 来源: 题型:
【题目】以废旧铅酸电池中的含铅废料(Pb、PbO、PbO2、PbSO4及炭黑等)为原料,制备粗铅,实现铅的再生利用。其工作流程如下图所示:
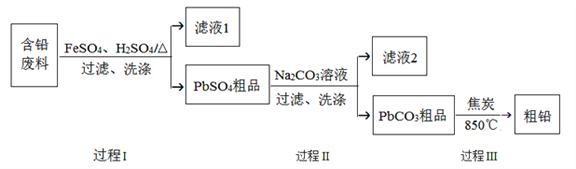
已知:Ksp(PbSO4)=1.6×10-5,Ksp(PbCO3)=3.3×10-14.
(1)过程Ⅰ中,在Fe2+催化下,Pb和PbO2反应生成PbSO4的化学方程式是__________。
(2)过程Ⅰ中,Fe2+催化过程可表示为:
i:2Fe2++ PbO2+4H++SO42-![]() 2Fe3++PbSO4+2H2O
2Fe3++PbSO4+2H2O
ii: ……
①写出ii的离子方程式:________________。
②下列实验方案可证实上述催化过程。将实验方案补充完整。
a.向酸化的FeSO4溶液中加入KSCN溶液,溶液几乎无色,再加入少量PbO2,溶液变红。
b.___________。
(3)过程Ⅱ的目的是脱硫。若滤液2中c(SO42-)=1.6mol/L,c(CO32-)=0.1mol/L,则PbCO3中____(填“是”或“否”)混有PbSO4。
(4)钠离子交换膜固相电解法是从含铅废料中提取铅的一种新工艺,其装置如图所示。将含铅废料投入阴极室,含铅废料中的PbSO4与NaOH溶液发 生反应:PbSO4+3OH-=HPbO2-+SO42-+H2O。
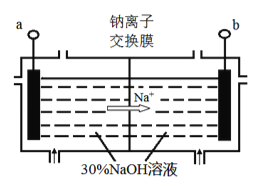
①a与外接电源的________极相连。
②电解过程中,PbO2、PbO、HPbO2-在阴极放电,其中PbO2放电的电极反应式为___________。
③与传统无膜固相电解法相比,使用钠离子交换膜可以 提高Pb元素的利用率,原因是________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com