
科目: 来源: 题型:
【题目】盐在化学工业中有重要的应用,请回答下列问题
(1)用离子方程式表示FeCl3可作净水剂的原因:___________________ 。
(2)常温下,在pH=3的硫酸与pH=11的Na2S溶液中,水电离出来的c(OH-)之比为_____ , 向Na2S溶液中加入AlCl3溶液时,产生白色沉淀和有臭鸡蛋味的气体,其离子方程式为:_________________。
(3)c(NH4+)相等的下列溶液① NH4Cl ②NH4HSO4 ③(NH4)2SO4 ④CH3COONH4
⑤NH3 H2O,溶液的物质的量浓度由小到大的顺序是__________ (用序号表示)
(4)已知t ℃时AgCl的Ksp=2×10-10 ;(2)在t ℃时,Ag2CrO4在水中的沉淀溶解平衡曲线如图所示。下列正确的是 _______
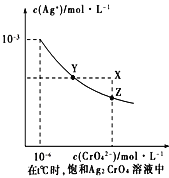
A.在t ℃时,Ag2CrO4的Ksp为1×10-9
B.t ℃时,在饱和Ag2CrO4溶液中加入K2CrO4 可使溶液由Y点到X点
C.在t ℃时,以0.01mol/L AgNO3溶液滴定20mL0.01 mol/L KCl和0.01 mol/L的K2CrO4的混合溶液,Cl-先沉淀
D.在t ℃时,AgCl的溶解度大于Ag2CrO4
(5)已知某温度时:Ksp[Fe(OH)3]=1×10-38,Ksp[Cu(OH)2]=1×10-20。在该温度下向Fe3+、Cu2+均为0.01molL-1的溶液中逐滴加入NaOH溶液,要Fe3+完全沉淀,而Cu2+不产生沉淀,溶液中PH应控制的范围是_______。(当离子浓度小于1×10-5mol/L时,认为完全沉淀)。
查看答案和解析>>
科目: 来源: 题型:
【题目】范德华力为akJ·mol-1,化学键为bkJ·mol-1,氢键为ckJ·mol-1,则a、b、c的大小关系为( )
A. a>b>cB. b>a>cC. c>b>aD. b>c>a
查看答案和解析>>
科目: 来源: 题型:
【题目】肼(N2H4)是一种无色易溶于水的油状液体。具有碱性和极强的还原性,在工业生产中应用非常广泛。

(1)已知肼的球棍棋型如图1所示,试写出肼的电子式:________。
(2)目前正在研发的一种肼燃料电池的结构如图2所示。________(填“a”或“b”)电极为电池的负极。
(3)在1L固定体积的容器中加入0.1molN2H4,在303K、Pt催化下发生:N2H4(I)![]() N2(g)+2H2(g),测得容器中
N2(g)+2H2(g),测得容器中![]() 与时间关系如图3所示,则04min氮气的平均速率v(N2)=________。
与时间关系如图3所示,则04min氮气的平均速率v(N2)=________。
查看答案和解析>>
科目: 来源: 题型:
【题目】下列对化学反应中能量变化的说法正确的是
A. 化学反应中一定伴有能量变化
B. 钠与水的反应是吸热反应
C. 放热反应发生时不必加热
D. Ba(OH)2·8H2O 与NH4Cl的反应是放热反应
查看答案和解析>>
科目: 来源: 题型:
【题目】现有属于前四周期的A、B、C、D、E、F、G七种元素,原子序数依次增大。A元素的价电子构型为nsnnpn+1;C元素为最活泼的非金属元素,D元素核外有三个电子层,最外层电子数是核外电子总数的1/6;E元素正三价离子的3d轨道为半充满状态,F元素基态原子的M层全充满,N层没有成对电子,只有一个未成对电子;G元素与A元素位于同一主族,其某种氧化物有剧毒。
(1)A元素的第一电离能 B元素的第一电离能(填“<”“>”或“=”),A、B、C三种元素电负性由小到大的顺序为 (用元素符号表示)。
(2)D元素原子的价电子排布式是 。
(3)C元素的电子排布图为 ;E3+的离子符号为 。
(4)F元素位于元素周期表的 区,其基态原子的电子排布式为 。
(5)G元素可能的性质 。
A.其单质可作为半导体材料
B.其电负性大于磷
C.最高价氧化物对应的水化物是强酸
查看答案和解析>>
科目: 来源: 题型:
【题目】已知1molH—H、Br—Br和H—Br键断裂时需要吸收的能量分别是436kJ、200kJ和369kJ,氢气与溴蒸汽化合生成1mol溴化氢时放出的能量akJ,则a为
A. -102 B. -51 C. 102 D. 51
查看答案和解析>>
科目: 来源: 题型:
【题目】设NA为阿伏加德罗常数的数值。下列有关叙述正确的是
A. 16g由O2和O3组成的混合气体中的氧原子数为2NA
B. 1molN2与足量H2充分反应生成NH3的分子数为2NA
C. 1mol Fe溶于过量稀硝酸,转移的电子数为3NA
D. 标准状况下,2.24L苯中含有的原子数为1.2NA
查看答案和解析>>
科目: 来源: 题型:
【题目】某元素R的最高价氧化物的水化物分子式是HnRO2n-2,则在气态氢化物的化学式是( )
A. H3n-10R B. H12-3n R C. H3n-4R D. H3n-12R
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com