
科目: 来源: 题型:
【题目】实验室里有4 个药品柜,已经存放有下列试剂
药品柜 | 甲柜 | 乙柜 | 丙柜 | 丁柜 |
药品 | 醋酸、乙醇 | CuSO4、MgCl2 | 白磷、硫黄 | 镁条、锌粒 |
实验室新购进一些碘化钾,应该将这些碘化钾放在
A. 甲柜 B. 乙柜 C. 丙柜 D. 丁柜
查看答案和解析>>
科目: 来源: 题型:
【题目】将1.92 g Cu和一定量的浓HNO3反应,随Cu不断减少,反应生成气体的颜色逐渐变浅,当Cu 完全消耗时,共收集到气体1.12 L(标况),反应中消耗HNO3物质的量为( )
A. 无法计算 B. 0.11 mol C. 0 .65 mol D. 0.8 mol
查看答案和解析>>
科目: 来源: 题型:
【题目】将SO2通入略显酸性的Fe(NO3)3溶液中,溶液由棕黄色变为浅绿色,但立即又变为棕黄色,此时若滴入BaCl2溶液,则会产生白色沉淀,在上述一系列变化过程中,最终被还原的微粒是
A.NO3-B.SO2C.Fe2+D.Fe3+
查看答案和解析>>
科目: 来源: 题型:
【题目】已知:A、B、C、D、E、F是周期表中前36号元素,A是原子半径最小的元素,B元素基态原子的2P轨道上只有两个电子,C元素的基态原子L层只有2对成对电子,D是元素周期表中电负性最大的元素,E2+的核外电子排布和Ar原子相同,F的核电荷数是D和E的核电荷数之和。
请回答下列问题:
(1)分子式为BC2的空间构型为__ __;F2+的核外电子排布式为 。
(2)A分别与B、C形成的最简单化合物的稳定性B____C(填“大于”或“小于”);A、C两元素可组成原子个数比为1:1的化合物,C元素的杂化类型为 。
(3)A2C所形成的晶体类型为_ ___;F单质形成的晶体类型为 ,其采用的堆积方式为 。
(4)F元素氧化物的熔点比其硫化物的____(填“高”或 “低”),请解释其原因____。
(5)D跟E可形成离子化合物,其晶胞结构如右图。该离子化合物晶体的密度为pg.cm。3,则晶胞的体积是 。(用含p的代数式表示)。

查看答案和解析>>
科目: 来源: 题型:
【题目】H2S燃料电池应用前景非常广阔,该电池示意图如下。下列说法正确的是( )
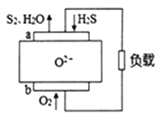
A. 电极a是正极 B. O2-由电极a移向电极b
C. 电极 a 的反应式为:2H2S+2O2--4e-=S2+2H2O D. 当通入1.12LO2,转移电子数0.2NA
查看答案和解析>>
科目: 来源: 题型:
【题目】人体正常的血红蛋白应含Fe2+。若误食外表与食盐相近的亚硝酸盐,则导致血红蛋白中的Fe2+转化成Fe3 +而中毒,服用维生素C可解除亚硝酸盐中毒,下列叙述中正确的是:
A.亚硝酸盐是还原剂
B.维生素C是还原剂
C.维生素C是氧化剂
D.亚硝酸盐被氧化
查看答案和解析>>
科目: 来源: 题型:
【题目】(1)写出下列化合物的名称或结构简式:
① _______________________________,
_______________________________,
②CH2=C(CH3)CH=CH2_______________________________,
③CH2=CHCOOH _______________________________,
④2,5-二甲基-2,4-己二烯的结构简式:_________________________________。
(2)麻黄素又称黄碱,是我国特定的中药材麻黄中所含有的一种生物碱,经我国科学家研究发现其结构如图:

①麻黄素中含氧官能团的名称是_________________,属于____________类(填“醇”或“酚”)。
②下列各物质:
A. 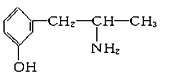 B.
B. 
C.  D.
D. 
E. 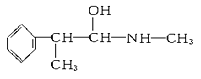
与麻黄素互为同分异构体的是________(填字母,下同),互为同系物的是________。
查看答案和解析>>
科目: 来源: 题型:
【题目】一定量的Fe、FeO、Fe2O3固体混合物,恰好溶解在0.1 mol盐酸中,并生成224mL(标况)的氢气。取同质量的上述固体与足量的CO高温反应后,固体质量减少( )
A. 条件不足 B. 0.72g C. 0.48g D. 0.64g
查看答案和解析>>
科目: 来源: 题型:
【题目】氮化硼(BN)晶体有多种相结构。六方相氮化硼是通常存在的稳定相,与石墨相似,只有层状结构,可作高温润滑剂。立方相氮化硼是超硬材料,有优异的耐磨性。它们的晶体结构如图所示。

(1)基态硼原子的电子排布式为___________________。
(2)下列关于这两种晶体的说法,正确的是______________(填序号)
a.立方相氮化硼含有σ键和π键,所以硬度大
b.六方相氮化硼层间作用力小,所以质地软
c.两种晶体的B-N键均为共价键
d.两种晶体均为分子晶体
e.立方相氮化硼的晶体晶胞中,含有4个B原子,4个N原子
(3)六方相氮化硼晶体层内一个硼原子与相邻氮原子构成的空间构型为___________,其结构与石墨相似却不导电,原因是________________________________。
(4)立方氮化硼和金刚石是等电子体,其晶胞如图所示,则处于晶胞顶点上的原子配位数为________________,若晶胞边长为361.5pm,则立方氮化硼的密度是______________g·cm-3(只要求列算式,不必计算出数值,阿伏加德罗常数的值为NA)。

(5)NH4BF4(氟硼酸铵)是合成氮化硼纳米管的原料之一,1mol NH4BF4含有___________mol配位键。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com