
科目: 来源: 题型:
【题目】将足量铁粉投入一定浓度的氯化铁和氯化铜的混合溶液中,充分反应后,溶液中剩余固体的质量与加人铁粉的质量相同,则原溶液中氯化铁和氯化铜的浓度之比为
A.2:7 B.3;4 C.4:7 D.2:3
查看答案和解析>>
科目: 来源: 题型:
【题目】下列叙述中,错误的是( )
A. 苯与浓硝酸、浓硫酸共热并保持55~60℃反应生成硝基苯
B. 苯乙烯在合适条件下催化加氢可生成乙基环己烷
C. 乙烯和溴的四氯化碳溶液反应生成1,2﹣二溴乙烷
D. 甲苯与氯气在光照下反应主要生成2,4﹣二氯甲苯
查看答案和解析>>
科目: 来源: 题型:
【题目】用足量的CO还原32.0g某种氧化物,将生成的气体通入足量澄清石灰水中,得到60g沉淀,则该氧化物是
A.FeO B.Fe2O3 C.CuO D.Cu2O
查看答案和解析>>
科目: 来源: 题型:
【题目】NaCN超标的电镀废水可用两段氧化法处理:
①NaCN与NaClO反应,生成NaOCN和NaCl
②NaOCN与NaClO反应,生成Na2CO3、CO2、NaCl和N2
已知HCN(K=6.3×10-10)有剧毒;HCN、HOCN中N元素的化合价相同。
完成下列填空:
(1)HClO的电子式为___________。
(2)第一次氧化时,溶液的pH应调节为____________(选填“酸性”、“碱性”或“中性”);原因是__________________________________________________。
(3)写出第二次氧化时发生反应的离子方程式。_______________________________________
(4)处理100 m3含NaCN 10.3 mg/L的废水,实际至少需NaClO______g(实际用量应为理论值的4倍),才能使NaCN含量低于0.5 mg/L,达到排放标准。
查看答案和解析>>
科目: 来源: 题型:
【题目】硫单质及其化合物在工农业生产中有着重要的应用。
(1)己知25℃时:O2(g)+S(s)=SO2(g) △H=-akJ·mol-1
O2(g) +2SO2(g)![]() 2SO3(g) △H = -b kJ·mol-1
2SO3(g) △H = -b kJ·mol-1
写出SO3(g)分解生成O2(g)与S(s)的热化学方程式:__________________。
(2)研究SO2催化氧化生成SO3的反应,回答下列相关问题:
①甲图是SO2(g)和SO3(g)的浓度随时间的变化情况。反应从开始到平衡时,用O2表示的平均反应速率为__________________。

②在一容积可变的密闭容器中充入20 mol SO2(g)和10mol O2(g),O2的平衡转化率随温度(T)、压强(P)的变化如图乙所示。则P1与P2的大小关系是P1______P2 ( “>”“ <”或“=”),A、B、C三点的平衡常数大小关系为__________(用KA、KB、KC和“<”“>” 或“=”表示)。
(3)常温下,H2SO3的电离平衡常数Ka1=1.54×10-2,Ka2=1.02×10-7。
①将SO2通入水中反应生成H2SO3。试计算常温下H2SO3![]() 2H++SO32-的平衡常数K =_____。(结果保留小数点后两位数字)
2H++SO32-的平衡常数K =_____。(结果保留小数点后两位数字)
②浓度均为0. 1 mol L-1的Na2SO3、NaHSO3混合溶液中,
 = ________。
= ________。
(4) 往1 L0.2 mol L-1 Na2SO3溶液中加入0.1 mol的CaCl2固体,充分反应后(忽略溶液体积变化),溶液中c(Ca2+)=_________。(已知,常温下Ksp(CaSO3)=1.28×l0-9)
(5)用含等物质的量溶质的下列溶液分别吸收SO2,理论吸收量最多的是__________(填序号)。
A.Na2SO3 B.Fe(NO3)3 C.Ba(OH)2 D.酸性 KMnO4
查看答案和解析>>
科目: 来源: 题型:
【题目】碱土金属指II A族的铍(Be)、镁(Mg)、钙(Ca)、锶(Sr)、钡(Ba)等元素,它们的单质及其化合物有着广泛的用途。
(1)Be基态原子的轨道表示式为_________________________;
镁和铝的笫二电离能:I2(Mg)_____I2(Al) (填“>”“ <”或“=”)。
(2)在500~600℃气相中,氯化铍以二聚体Be2Cl4, ( )的形式存在,在1000 ℃,氯化铍则以BeCl2形式存在。
)的形式存在,在1000 ℃,氯化铍则以BeCl2形式存在。
①在二聚体Be2Cl4中Be的杂化方式为___________,1mol Be2Cl4中含有_________mol 配位键。
②MgCl2的熔、沸点比BeCl2高的原因是____________________。
(3)根据巴索洛规则:一般来讲,盐中阴、阳离子半径相差较大时,其溶解度较大。则在水中溶解度 S(SrF2)____S(BaF2) (填“>” “<””或“=”)。
(4)石灰氮(CaCN2)—种碱性肥料,可用作除草剂、杀菌剂、杀虫剂等。
①CaCN2中阴离子为CN22-,与CN22-互为等电子体的分子有N2O和________(填化学式),写出CN22-的电子式___________。
②CaCN2与水反应生成CaCO3和NH3两种物质,则1mol CaCN2与水反应的过程中,反应物断裂的σ键总数_______________。
(5) Mg2+与Ni2+、 O2-形成晶体的晶胞结构如图所示(Ni2+未画出),则该晶体的化学式为_________。已知该品胞参数a pm.则该晶体的密度为_________g·cm-3(用a和NA表示)。
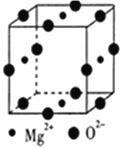
查看答案和解析>>
科目: 来源: 题型:
【题目】(6分)能源是影响经济和生活的重要因素。目前人类已开发和利用的能源中,氢气是一种最理想的清洁能源。试填写下列空格。
(1)点燃氢气时,化学能主要转化为 ;
(2)氢气在原电池中反应时,化学能主要转化为 ;
(3)若在常温常压下,上述两种方式都反应1molH2,则放出的能量 (填“相同”或“不相同”)。
查看答案和解析>>
科目: 来源: 题型:
【题目】实验室用氨气还原氧化铜的方法测定铜的近似相对原子质量,反应的化学方程式为
2NH3+3CuO![]() N2+3Cu+3H2O,试回答:
N2+3Cu+3H2O,试回答:
(1)如果选用测定反应物CuO和生成物H2O的质量[m(CuO)、m(H2O)]时,请用下列仪器设计一个简单的试验方案。
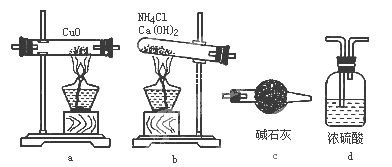
① 仪器连接的顺序(用字母编号表示,仪器可重复使用 )__________;d中浓硫酸的作用是___________,___________________;实验完毕时观察到a中的现象是_____________________;
②列出计算Cu的相对原子质量的表达式__________________;
③下列情况将使测定结果偏大的是_____________。(以下选择填空不限1个正确答案,均用字母标号填写)
A.CuO未全部还原为Cu B.CuO受潮 C.CuO中混有Cu
(2)如果仍采用上述仪器装置,其他方案可选用测定的物理量有___________。
A.m (Cu)和m(CuO) B. m (N2)和m (H2O)
C.m (Cu)和m(H2O) D.m(NH3)和m (H2O)
查看答案和解析>>
科目: 来源: 题型:
【题目】高分子材料M在光聚合物和金属涂料方面有重要用途,已知
①磷酸的结构简式为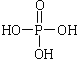
②M的结构简式为: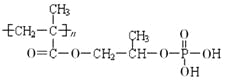
工业上合成M的过程可表示如下:
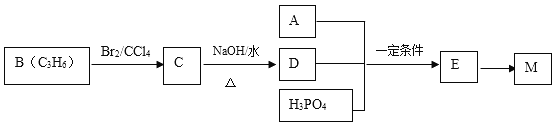
已知:A完全燃烧只生成CO2和H2O,其蒸气密度是相同状况下氢气密度的43倍,分子中H、O原子个数比为3:1。它与Na或Na2CO3都能反应产生无色气体。
(1)A中含有的官能团的名称是 。
(2)下列说法正确的是 (填字母序号)。
a.工业上,B主要通过石油分馏获得
b.C的同分异构体有2种(不包括C)
c.D易溶于水
d.E→M的反应是缩聚反应
(3)写出A+D+H3PO4→E反应的化学方程式(反应物均用结构简式表示): ,该反应类型是 反应。
(4)F是A 的一种同分异构体,F的核磁共振氢谱显示分子中有两种不同的氢原子。F存在下列转化关系:
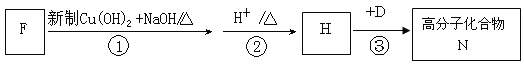
写出F、N的结构简式F: ,N: 。
写出反应①的化学方程式 。
查看答案和解析>>
科目: 来源: 题型:
【题目】一定质量的某有机物和足量钠反应,可得Va L气体,等质量的该有机物如果与足量NaHCO3反应,同温同压得到Vb L气体,若Va=Vb,则该有机物可能是( )
A.HOCH2COOH B.HO—CH2CH2—CHO C.HOOC—COOH D.CH3COOH
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com