
科目: 来源: 题型:
【题目】为了强化安全管理,某油库引进了一台空气中汽油含量的测量仪,其工作原理如图所示(用强酸性溶液作电解质溶液)。下列说法中不正确的是

A. 石墨电极作正极,发生还原反应
B. 铂电极的电极反应式为:C8H18+16H2O-50e-=8CO2+50H+
C. H+由质子交换膜左侧向右侧迁移
D. 每消耗标准状况下5.6 L O2溶液中通过lmol 电子
查看答案和解析>>
科目: 来源: 题型:
【题目】下列离子方程式表达正确的是
A. 硫酸亚铁酸性溶液中加入过氧化氢:2Fe2++ H2O2 +2H+= 2Fe3++2H2O
B. 用食醋除水垢:CaCO3+2H+=Ca2++CO2↑+H2O
C. 向NaClO溶液中通入少量SO2: 2C1O-+SO2+H2O=SO32-+2HClO
D. Na2S溶于水呈碱性:S2-+ 2H2O![]() H2S +2OH-
H2S +2OH-
查看答案和解析>>
科目: 来源: 题型:
【题目】下列说法不正确的是( )
A. ![]() C和
C和![]() C是碳元素的2种核素,它们互为同位素
C是碳元素的2种核素,它们互为同位素
B. 化学研究者开发出被称为第五形态的固体碳,这种新的碳结构称作“纳米泡沫”,它外形类似海绵,比重极小,并具有磁性。纳米泡沫碳与C60互称同素异形体
C.  与
与 互为同分异构体
互为同分异构体
D. 硝基苯可看成是由![]() 和—NO2两种基团组成
和—NO2两种基团组成
查看答案和解析>>
科目: 来源: 题型:
【题目】下列现象或操作不适宜用勒夏特列原理解释的是
A. 实验室可用CaO和浓氨水快速制取氨气
B. FeCl3溶液中加Fe粉,颜色由棕黄色变为浅绿色
C. 新制氯水放置一段时间颜色变浅
D. 锅炉水垢中含有CaSO4,常先加Na2CO3再加酸处理
查看答案和解析>>
科目: 来源: 题型:
【题目】I、写出下列反应的离子方程式:
(1)制取氢氧化铁胶体的离子方程式:________________;
(2)在强碱溶液中次氯酸钠与Fe(OH)3反应生成Na2FeO4的离子方程式:___________;
II、某无色溶液,其中可能存在Na+、Ba2+、AlO2﹣、S2﹣、SO32﹣、SO42﹣.取该溶液进行有关实验,实验结果如图所示:请回答: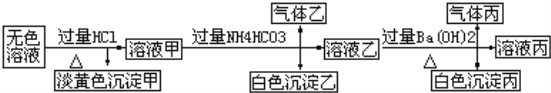
(1)生成沉淀甲的离子方程式为____________________________________________________.
(2)由溶液甲生成沉淀乙的离子方程式为______________________________________________.
(3)沉淀丙的成分为_______;
(4)综合上述信息,该溶液中肯定存在的离有:___________________________________________.
查看答案和解析>>
科目: 来源: 题型:
【题目】对氨基苯甲酸酯类是一类局部麻醉药,化合物M是该类药物之一。合成M的一种路线如下:

已知以下信息:
①核磁共振氢谱显示B只有一种化学环境的氢,H苯环上有两种化学环境的氢。
② 。
。
③E为芳香烃,其相对分子质量为92。
④![]() (苯胺,易被氧化)。
(苯胺,易被氧化)。
回答下列问题:
(1)A的结构简式为_________________,其化学名称是_____________________。
(2)由E生成F的化学方程式为_________________________________________。
(3)由G生成H的反应类型为__________________,H在一定条件下可以发生聚合反应,写出该聚合反应的化学方程式__________________________________________________。
(4)M的结构简式为________________________________。
(5)D的同分异构体中不能与金属钠反应生成氢气的共有_________种(不考虑立体异构),其中核磁共振氢谱只有两组峰,且峰面积比为6:1的是_________________(写结构简式)。
(6)参照上述合成路线,以乙烯和环氧乙烷为原料(无机试剂任选)制备1,6-己二醛,设计合成路线 ___________________________________________________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】治理氮氧化物(NOx)的污染是化学研究的重要课题之一。NO能被灼烧的铁粉还原为N2,同时生成同时生成FeO,利用下列装置模拟该反应。

已知:①浓硝酸可氧化NO;②NaOH溶液能与NO2反应,不与NO反应。
(1)上述装置接口的连接顺序为a→__________(按气流方向,用小写字母表示)。
(2)装置D的作用是___________________。
(3)装置E中反应的化学方程式为___________________。
(4)打开分液漏斗活塞,烧瓶中观察到的实验现象有_____________________。
(5)实验室常用NaOH溶液吸收多余的氮氧化物(NOx):NO+NO2+2NaOH=2NaNO2+H2O。设计实验验证产物NaNO2既有氧化性又有还原性。
限选试剂:稀硫酸、KI-淀粉溶液、双氧水、酸性高锰酸钾溶液
实验步骤 | 实验操作 | 现象 | 实验结论 |
1 | __________ | __________ | NaNO2具有氧化性 |
2 | __________ | __________ | NaNO2具有还原性 |
(6)最终得到的亚硝酸钠(NaNO2)外观与食盐非常相似,毒性较强。
已知①Ksp(AgNO2) =2.0×10-8,Ksp(AgCl) =1.8×10-10;
② Ka(HNO2) =5.1×10-4。
若鉴别NaNO2和NaCl两种固体,实验方法是__________________________(试剂自选)。
查看答案和解析>>
科目: 来源: 题型:
【题目】砷为VA族元素,金属冶炼过程产生的含砷有毒废弃物需处理与检测。
I.冶炼废水中砷元素主要以亚砷酸(H3AsO3)形式存在,可用化学沉降法处理酸性高浓度含砷废水,其工艺流程如下:

已知:①As2S3与过量的S2-存在以下反应:As2S3(s)+3S2-(aq)![]() 2AsS33-(aq);
2AsS33-(aq);
②亚砷酸盐的溶解性大于相应砷酸盐。
(1)亚砷酸中砷元素的化合价为________;砷酸的第一步电离方程式为_____________。
(2)“一级沉砷”中FeSO4的作用是___________;“二级沉砷”中H2O2与含砷物质反应的化学方程式为_____________。
(3)沉淀X为___________(填化学式)。
Ⅱ.冶炼废渣中的砷元素主要以As2S3的形式存在,可用古氏试砷法半定量检测(As的 最低检出限为3.0×10-6g)。
步骤1:取10g废渣样品,粉碎后与锌粉混合,加入H2SO4共热,生成AsH3气体。
步骤2:将AsH3气体通入AgNO3溶液中,生成银镜和As2O3。
步骤3:取1g废渣样品,重复上述实验,未见银镜生成。
(4)AsH3的电子式为_______________。
(5)步骤2的离子方程式为_________________。
(6)固体废弃物的排放标准中,砷元素不得高于4.0×10-5g·kg-1,请通过计算说明该排放的废渣中砷元素的含量_______(填“符合”、“不符合”)排放标准,原因是__________
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com