
科目: 来源: 题型:
【题目】在温度、容积相同的3个密闭容器中,按不同方式投入反应物,保持恒温、恒容,测得反应达到平衡时的有关数据如下[已知N2(g)+3H2(g)![]() 2NH3(g) ΔH=-92.4 kJ·mol-1]:
2NH3(g) ΔH=-92.4 kJ·mol-1]:
容器 | 甲 | 乙 | 丙 |
反应物投入量 | 1 mol N2、3 mol H2 | 2 mol NH3 | 4 mol NH3 |
NH3的浓度(mol·L-1) | c1 | c2 | c3 |
反应的能量变化 | 放出a kJ | 吸收b kJ | 吸收c kJ |
体系压强(Pa) | p1 | p2 | p3 |
反应物转化率 | α1 | α2 | α3 |
下列说法正确的是
A. 2c1>c3 B. a+b=92.4 C. 2p2<p3 D. α1+α3>1
查看答案和解析>>
科目: 来源: 题型:
【题目】已知A、B、C、D、E、F是分属三个短周期六种主族元素,且原子序数依次增大。①B是植物生长三要素之一,它能形成多种氧化物,某些氧化物会造成光化学污染。②C和D能形成电子总数为30和38的两种化合物。③E的某种氧化物M可用做漂白剂。请回答下列问题:
(1)元素F在元素周期表中的位置是______________________________。
(2) C、D、E 三种元素原子半径由小到大的顺序是__________________(用元素符号回答); C、D、E 三种元素形成的简单离子的离子半径由小到大的顺序是__________________ (用离子符号回答)。
(3) C和D形成电子总数为38的化合物中化学键类型有__________________________(填“离子键”、“极性共价键”、“非极性共价键”)。
(4)写出D的最高价氧化物水化物的电子式______________________。
(5) E、F两种元素形成氢化物中还原性较强的是_________________(填化学式); 用电子式表示该化合物的形成过程________________________________________。
(6)C、D、F形成的某种化合物N也可用做漂白剂,M、N以物质的量1∶1混合,混合物没有漂白性。用离子方程式解释其原因_____________________________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】下列有关除杂质(括号中为杂质)的操作中,肯定错误的是( )
A.乙烷(乙烯):通过盛有足量溴水的洗气瓶
B.溴乙烷(乙醇):多次加水振荡,分液,弃水层
C.乙醇(水):蒸馏
D.溴苯(溴):加稀氢氧化钠溶液充分振荡洗涤后分液
查看答案和解析>>
科目: 来源: 题型:
【题目】下列说法不正确的是
A. 用溴水一种试剂可将苯、四氯化碳、乙烯、乙醇、苯酚鉴别开
B. 组成为C4H10O的醇与乙二酸在一定条件下生成二元酯的种类有10种
C. 二糖、淀粉、纤维素水解的最终产物都是葡萄糖
D. 芥子醇结构简式是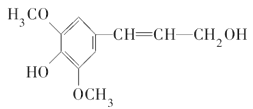 ,则分子中所有碳原子可能在同一平面且与足量溴水反应,最多消耗1molBr2
,则分子中所有碳原子可能在同一平面且与足量溴水反应,最多消耗1molBr2
查看答案和解析>>
科目: 来源: 题型:
【题目】醇酸树脂合成技术成熟、原料易得、涂膜的综合性能良好,是涂料用合成树脂中用量最大、用途最广的品种之一,新型环保醉酸树脂的合成线路如图所示:

(1)E的化学名称是______, D中官能团的名称是____________。
(2)反应①的有机反应类型是_________。
(3)下列说法正确的是_________(填字母编号)。
a.化合物A的核磁共振氢谱有3组峰
b.油脂、蔗糖、麦芽糖酸性水解都能得到2种物质
c. 检验B中所含官能团时,加试剂的顺序依次是过氢量氧化钠溶液、硝酸银溶液
d. 1molC 与足量的银氨溶液反应能生成4 mol Ag
e. 1molE 与足童的金属钠反应产生33.6L H2 (标准状况下)
(4)写出C![]() D的化学方程式:_________。
D的化学方程式:_________。
(5)在Cu 作催化剂,F(C8H10O2)与O2生成C,则F的同分异构体中,符合下列条件的芳香族化合物的结构简式有___________。
a.遇FeCl3溶液发生显色反应;
b.发生消去反应后生成的化合物核磁共振氢谱有5组峰;
(6)已知:RCH3CH=CH2![]() RCHClCH=CH2。上述合成路线,以2-丙醇为原料(无机试剂任选),设计制备OHC-CH2-CHO的合成路线___________。
RCHClCH=CH2。上述合成路线,以2-丙醇为原料(无机试剂任选),设计制备OHC-CH2-CHO的合成路线___________。
查看答案和解析>>
科目: 来源: 题型:
【题目】已知:2H2S(g)+O2(g)===S2(s)+2H2O(l) ΔH=-632 kJ·mol-1。右图为H2S燃料电池的示意图。下列说法正确的是( )
A. 电极a为电池的正极
B. 电极b上发生的电极反应为O2+2H2O+4e-===4OH-
C. 每有1 mol氧气参加反应,电池内部吸收632 kJ热能
D. 每34 g H2S参与反应,电路中有2 mol电子通过
查看答案和解析>>
科目: 来源: 题型:
【题目】某小组探究用4HCl+O2![]() 2H2O+2Cl2的方法制取Cl2并验证其性质,设计实验如图所示(夹持装置略去)。请回答下列问题:
2H2O+2Cl2的方法制取Cl2并验证其性质,设计实验如图所示(夹持装置略去)。请回答下列问题:

(1)对装置B进行气密性检查的方法是____________。
(2)装置E中盛放无水CuSO4的仪器名称为_____;此装置的现象及作用是_______。
(3)设计实验检测上述方法得到的Cl2中是否含有HCl:__________。
(4)该小组用制得的Cl2和如图所给装置(不能重复使用)依次验证干燥纯净的Cl2无漂白性、湿润的Cl2有漂白性、Cl的非金属性强于S。按气流从左到右的方向,装置依次连接的合理顺序为F、___________、J。

(5)若I中的试剂X为Na2S溶液,写出反应的离子方程式:________。”
(6)吸收尾气使用的是200mL 1.0 mol·L-1氢氧化钠溶液,配制此溶液需要的玻璃仪器有胶头滴管、玻璃棒、_______、________等。
查看答案和解析>>
科目: 来源: 题型:
【题目】偏钒酸镁在化工“新型材料”光电领域有着重要的用途。以硼泥[主要成分是MgO(52.1%),还有Fe2O3、FeO、Al2O3、SiO2等杂质]为原料设计制备偏钒酸镁的生产工艺如图所示:
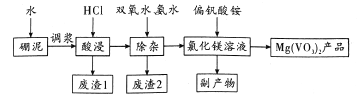
回答下列问题:
(l)Mg(VO3)2 中V的化合价为_____,副产物的电子式为_______。
(2)酸浸时,反应温度需控制在80℃,在实验室可采取的措施为______。写出”酸浸”后溶液中存在的金属阳离子_______,废渣1可用于制作_______,该物质在信息传输中具有重要应用。
(3)“除杂”过程加人双氧水的目的是_______(用离子方程式表示)。此过程中使Fe3+、Al3+浓度均小于l×10-6mol·L-1,在室温下需调节pH范围为__________[已知Ksp[Fe(OH)3]= 1×10-39, Ksp[Al(OH)]=1×10-33, pH=9.3时,Mg2+开始沉淀]。
(4)如何检验滤液中Fe3+是否被除尽,简述检验操作:__________。
(5)偏钒酸氨可由VOSO4溶液中加入氯酸钾将其氧化,然后用氨水调节pH即可制得,写出VO2+被氯酸钾氧化的离子方程式_________。
(6)现用a t硼泥生产Mg(VO3)2,若生产过程的产率为6%,则能生产出Mg(VO3)2产品的
质量为_________t (用含a、b的代数式表示)。
查看答案和解析>>
科目: 来源: 题型:
【题目】如图所示,以稀土金属材料作惰性电极,在两极上分别通入甲烷与空气,电解质为掺杂了Y2O3的 ZrO3固体,它在高温下能传导O2-。下列说法正确的是( )

A. c电极名称为负极
B. d电极上发生反应:CH4-8e-+4O2-===CO2+2H2O
C. O2-向c电极移动
D. 空气通入的电极为负极
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com