
科目: 来源: 题型:
【题目】下列关于硅及其化合物的说法不正确的是
A. 高纯硅具有良好的半导体性能,可制成硅芯片、光电池、光导纤维等
B. 二氧化硅能与氢氟酸反应,可用氢氟酸刻蚀玻璃
C. 向硅酸钠溶液中滴加稀盐酸有不溶物生成,实验室可用该方法制备硅酸
D. “硅胶”由硅酸凝胶经干燥、脱水制得,常用作食品、药品等的干燥剂
查看答案和解析>>
科目: 来源: 题型:
【题目】下列有关组成生物体细胞的化学元素的叙述,错误的是
A. 构成细胞的最基本元素是碳
B. H7N9病毒和桃树共有的元素是C、H、0、N、P等
C. 生物体内含有的元素都是生物体所必需的
D. Cu、Mn、Mo、B都是组成生物体的微量元素
查看答案和解析>>
科目: 来源: 题型:
【题目】今有A、B、C、D、E、F六种装置,如图所示。(胶塞、导管可自由选用)


(1)写出①~④的仪器名称:①__________,②__________,③________,④________。
(2)实验室制取并收集氧气时应选择________和________相连接,制取并收集氢气时应选择________和________相连接。
(3)做木炭还原氧化铜并检验生成气体的实验,应选择________和________相连接,检验气体时观察到的实验现象是__________________________________________________。
(4)制取氢气并做还原氧化铜的实验,应选择________和________装置,实验结束时应先停止加热,待试管冷却后,再停止通氢气,其原因是______________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】(7分)某含有一个双键的气态烯烃和另一气态烷烃的混合气体,在同温同压下其密度是H2的13.2倍。在标准状况下将4.48L混合气体通过足量的溴水,结果溴水增重3.36g,求原混合气体中各烃的体积分数。 (注:此题必须写出过程,否则不得分)
查看答案和解析>>
科目: 来源: 题型:
【题目】黑火药爆炸时发生的反应为:S + 2KNO3 + 3C = K2S + N2↑+3CO2↑,下列说法错误的是( )
A. C在反应中作氧化剂 B. S和KNO3都发生了还原反应
C. CO2是氧化反应的产物 D. K2S和N2都是还原反应的产物
查看答案和解析>>
科目: 来源: 题型:
【题目】常温下,向100 mL 0.01 mol·L-1 HA溶液中逐滴加入0.02 mol·L-1 MOH溶液,图中所示曲线表示混合溶液的pH变化情况(稀溶液混合时体积可直接相加)。下列判断错误的是
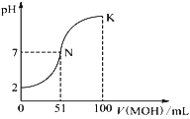
A. 由图中信息可知,HA一定是强酸
B. 当V(MOH)=50.00 mL时,混合溶液中c(M+)+c(MOH)=0.01 mol·L-1
C. N点对应的溶液中c(M+)=c(A-)
D. K点所对应的溶液中离子浓度大小关系为:c(M+)>c(A-)>c(OH-)>c(H+)
查看答案和解析>>
科目: 来源: 题型:
【题目】现有m g某气体,它由双原子分子构成,它的摩尔质量为M g·mol-1。若阿伏加德罗常数用NA表示,则:
(1)该气体的物质的量为________mol。
(2)该气体所含原子总数为________个。
(3)该气体在标准状况下的体积为____________L。
(4)该气体溶于水后形成VL溶液,其溶液的物质的量浓度为____________ mol/L。
(5)该气体溶于1 L水中(不考虑反应),其溶液中溶质的质量分数为_______________。
查看答案和解析>>
科目: 来源: 题型:
【题目】下列有关硅及其化合物的描述不正确的是
A. SiO2可用于制造光导纤维 B. H2SiO3可以用二氧化硅和水反应制得
C. 普通玻璃是以纯碱、石灰石和石英为原料制成的 D. 盛装NaOH溶液的试剂瓶不用玻璃塞的原因是因为玻璃塞与NaOH溶液反应
查看答案和解析>>
科目: 来源: 题型:
【题目】纯过氧化氢是淡蓝色的黏稠液体,可与水以任意比混合,其水溶液俗称双氧水,为无色透明液体。实验室常用过氧化氢制取氧气,工业上过氧化氢是重要的氧化剂和还原剂,常用于消毒、杀菌、漂白等。某化学兴趣小组的同学围绕过氧化氢开展了调查研究与实验,请你参与其中一起完成下列学习任务:
(1)写出过氧化氢的电子式:________。
(2)实验室中用过氧化氢制取氧气的化学方程式为_______________,当生成标准状况下1.12 L O2时,转移电子为________ mol。
(3)该兴趣小组的同学查阅资料后发现H2O2为二元弱酸,其酸性比碳酸弱。请写出H2O2在水溶液中的电离方程式:______________________。
(4)同学们用0.1000 mol·L-1的酸性高锰酸钾标准溶液滴定某试样中过氧化氢的含量,反应原理为2MnO4-+5H2O2+6H+===2Mn2++8H2O+5O2↑。
①在该反应中,H2O2被________(填“氧化”或“还原”)。
②滴定到达终点的现象是______________________________________。
③用移液管吸取25.00 mL试样置于锥形瓶中,重复滴定四次,每次消耗的酸性KMnO4标准溶液体积如下表所示:
第一次 | 第二次 | 第三次 | 第四次 | |
体积(mL) | 17.10 | 18.10 | 17.00 | 16.90 |
则试样中过氧化氢的浓度为________mol·L-1。
④若滴定前尖嘴中有气泡,滴定后消失,则测定结果____(填“偏低”、“偏高”或“不变”)。
(5)同学们发现向滴加了酚酞的NaOH溶液中加入H2O2后,溶液中红色消失。关于褪色原因:甲同学认为H2O2是二元弱酸,消耗了OH-使红色消失;乙同学认为H2O2具有漂白性使溶液褪色。请设计一个简单的实验方案来判断甲、乙两位同学的说法是否正确_____________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com