
科目: 来源: 题型:
【题目】化学与生活密切相关,下列有关说法错误的是
A. “地沟油”可以转化为生物柴油,提高资源的利用率
B. 丝绸和棉花的组成元素不完全相同
C. 木糖醇虽然有甜味,但不属于糖类
D. 向牛奶中加入果汁会出现沉淀,这是因为发生了中和反应
查看答案和解析>>
科目: 来源: 题型:
【题目】下列说法正确的是( )
A. 生石灰能与水反应,可用于实验室干燥氯气
B. NO2、、SO2二种气体都能与水反应生成酸,它们都是酸性氧化物
C. SO2、NOx的大量排放会导致酸雨的发生
D. 高温下,二氧化硅与碳酸钠反应放出CO2,可说明硅酸的酸性比碳酸强
查看答案和解析>>
科目: 来源: 题型:
【题目】如图所示,E为浸过含酚酞的Na2SO4溶液的滤纸。A、B分别为铂片,压在滤纸两端,R、S为电池的电极。M、N是用多微孔的Ni制成的电极,在碱溶液中可视为惰性电极。G为电流计,K为开关。C、D和电解池中都充满浓KOH溶液。若在滤纸中央滴一滴紫色的KMnO4溶液,将开关K打开,接通电源一段时间后,C、D中有气体产生。

请回答下列问题:
(1)R为________(填“正”或“负”)极。
(2)A附近溶液的现象是_________________________________________,
B附近发生的电极反应式为_____________________________________。
(3)滤纸上的紫色点向________(填“A”或“B”)方向移动。
(4)当C、D中的气体产生到一定量时,切断外电源并接通开关K,经过一段时间后,C、D中的气体逐渐减少,C中的电极为________(填“正”或“负”)极,电极反应式为_______________________________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】下列有关物质的分类或性质与应用均正确的是
A. SO2和Cl2都能使品红溶液褪色,两者等体积混合可以增强漂白能力
B. Na2O2是碱性氧化物,具有强氧化性可用于杀菌消毒
C. MgO、Al2O3的熔点很高,二者都可用于制作耐高温材料
D. Al(OH)3是一种强碱,可以与酸反应,可用作医用的胃酸中和剂
查看答案和解析>>
科目: 来源: 题型:
【题目】有机物W是合成某药物的中间体,其结构简式如下:
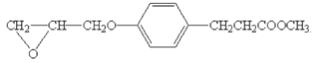
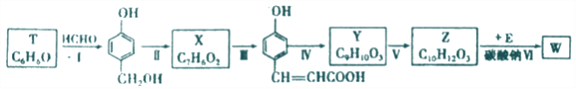
以有机物T为原料合成W的流程如图(部分条件省略):
己知:RCH2ONa+CH3CH2X![]() RCH2OCH2CH3+NaX
RCH2OCH2CH3+NaX
请回答下列问题:
(1) Y中所含的官能团有_______.
(2)步骤Ⅵ中Na2CO3的作用为_______。
(3)请写出下列各步骤的反应类型:Ⅰ.__________;Ⅱ._________;Ⅴ.__________。
(4)利用步骤I的反应物,可制备某线型结构高分子,请写出相关化学反应方程式__________。
(5)物质X 最多可消耗H2______mol ,最终产物与足量HCOOH 完全反应的方程式为_______ 。
(6)写出同时满足下列条件的Y的所有同分异构体的结构简式:_______。
① 苯环上只有一个取代基
② 等量有机物分别与足量钠、足量碳酸氢钠溶液反应产生气体的物质的量相等
③ 在核磁共振氢谱图上有7个峰
查看答案和解析>>
科目: 来源: 题型:
【题目】五种短周期元素A、B、C、D、E的性质及结构信息如下:
① 原子半径A>B>C>D>E;
② 五种元素之间形成的常见的四种分子如下:
甲 | 乙 | 丙 | 丁 | |
比例模型 |
|
|
|
|
组成元素 | D、E | B、E | A、D、E | C、E |
电子总数 | 10 | 18 | 26 | 10 |
请根据上述信息回答下列问题:
(1)A元素的单质与物质甲发生反应的离子方程式为__________,其化学反应平衡常数的表达式为_______。
(2)戊与乙互为同系物,有五种同分异构体,戊的分子式为_____,己与乙具有相同的电子数,与甲含有的元素种类相同,己分子的结构式为_______。
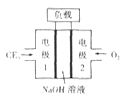
(3)C与E元素组成的CE3与液氮可组成燃料电池,产物均为无污染的物质,可用于驱动潜艇,燃料电池装置如下图所示。该电池的负极反应式为_____。电池工作时OH-向_____移动(填“正极”或“负极”)。
(4)B与D组成的一种物质在自然界中可循环,循环时其与CaCO3反应。已知Ksp(CaCO3)=2.8×10-9,现将CaCl2溶液与Na2CO3溶液等体积混合,若Na2CO3溶液的浓度为2×10-4mol/L,则生成沉淀的最小浓度为__________(忽略混合前后溶液的体积变化)。
查看答案和解析>>
科目: 来源: 题型:
【题目】下图是中学化学中常用于混合物分离和提纯的装置。

回答下列问题:
(1)从氯化钾溶液中得到氯化钾固体,选择装置____________(填代表装置图的字母,下同);除去自来水中的Cl-等杂质,选择装置____________。从碘水中分离出I2,选择装置___________,该分离方法的名称为_________________。
(2)装置A中①的名称是________,进水的方向是____________。温度计水银球的位置是在__________;装置B在分液时,打开活塞后发现液体不能顺利滴下,其可能的原因是__________。。
(3)从碘水中得到碘时,不能选用的试剂是______(填字母)。
A.酒精 B.苯 C.四氯化碳
(4)若选择试剂X(密度小于水的密度)从碘水中提取碘时,充分振荡、静置后。下层液体的颜色为________。
查看答案和解析>>
科目: 来源: 题型:
【题目】FeCl3是中学实验室常用的试剂。
(1)写出氯化铁在水中的电离方程式:_________。
(2)利用氯化铁溶液制备氢氧化铁胶体。
①下列制备氢氧化铁胶体的操作方法正确的是_______(填字母)。
A.向饱和氯化铁溶液中滴加适量的氢氧化钠稀溶液
B.加热煮沸氯化铁饱和溶液
C.在氨水中滴加氯化铁浓溶液
D.在沸水中滴加饱和氯化铁溶液,煮沸至出现红褐色液体
②区别氯化铁溶液和氢氧化铁胶体的方法是___________。
(3)为了探究离子反应的本质,设计如下实验:
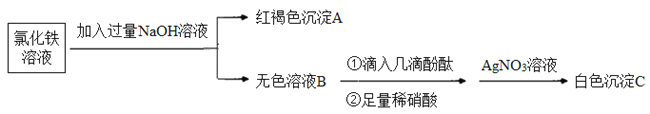
①写出生成A的离子方程式:_________。
②上述流程中,加入足量稀硝酸的目的是________。如何判定无色溶液B与稀硝酸发生了离子反应?________。
查看答案和解析>>
科目: 来源: 题型:
【题目】弱酸溶液中存在电离平衡。室温下,几种弱酸的电离常数如下:
①醋酸 Ka=1.8×10-5 ②草酸 Ka1=5.9×10-2,Ka2=6.4×10-5
③硼酸 Ka=5.8×10-10 ④邻-苯二甲酸 Ka1=1.1×10-3,Ka2=3.9×10-6
(1)25 ℃时,0.1 mol/L的上述四种酸溶液,pH由小到大的顺序是__________(用序号表示)。
(2)25 ℃时,0.1 mol/L醋酸溶液的pH=______(lg1.8=0.26)。已知:弱电解质在溶液中达到电离平衡时,溶液中已经电离的电解质分子数占原来电解质总分子数的百分数叫电离度。将0.1 mol/L醋酸溶液稀释10倍,其电离度变为原来的______倍(用代数式表示)。
(3)Na2C2O4第一步水解反应的平衡常数表达式是__________,室温下,向0.01 mol/LNa2C2O4溶液中滴加盐酸至pH=1时,溶液中HC2O4-与H2C2O4物质的量浓度之比为______。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com