
科目: 来源: 题型:
【题目】已知:2Fe3++2I===2Fe2++I2,Br2+2Fe2+===2Br+2Fe3+,由此可判断离子的还原性从强到弱的顺序是
A. Br>Fe2+>I B. I>Fe2+>Br C. Br>I>Fe2+ D. Fe2+>I>Br
查看答案和解析>>
科目: 来源: 题型:
【题目】工业由钛铁矿(主要成分FeTiO3,Fe2O3、Al2O3、FeO、SiO2等杂质)制备TiCl4的工艺流程如下:

已知:
①酸浸 FeTiO3(s)+2H2SO4(aq)=FeSO4(aq)+TiOSO4(aq)+2H2O(l)
②水解 TiOSO4(aq)+2H2O(l)![]() H2TiO3(s)+H2SO4(aq)
H2TiO3(s)+H2SO4(aq)
③煅烧 H2TiO3(s)![]() TiO2(s)+H2O(s)
TiO2(s)+H2O(s)
(1)FeTiO3中钛元素的化合价为 ,试剂A为 。
(2)碱浸过程发生反应的离子反应方程式为 。
(3)酸浸后需将溶液温度冷却至70℃左右,若温度过高会导致最终产品吸收率过低,原因是 。
(4)上述流程中氯化过程的化学反应方程式为 。
已知TiO2(s)+2Cl2(g)![]() TiCl4(l)+O2(g) △H=+151kJ·mol-1。该反应极难进行,当向反应体系中加入碳后,则反应在高温条件下能顺利发生。从化学平衡的角度解释原因是 。
TiCl4(l)+O2(g) △H=+151kJ·mol-1。该反应极难进行,当向反应体系中加入碳后,则反应在高温条件下能顺利发生。从化学平衡的角度解释原因是 。
(5)TiCl4极易水解,利用此性质可制备纳米级TiO2·xH2O,该反应的化学反应方程式是 。
查看答案和解析>>
科目: 来源: 题型:
【题目】
钛镍形状记忆合金(TiNi)被广泛用于人造卫星和宇宙飞船的天线,在临床医疗领域内也具有广泛的应用。回答下列问题:
(1)写出基态Ti原子的电子排布式:_________,Ni在元素周期表中的位置是_________。
(2)钛镍合金能溶于热的硫酸生成Ti(SO4)2、NiSO4,二者阴离子的立体构型为______,中心原子的轨道杂化类型是_______。
(3)工业上将金红石(主要成分TiO2)转化为液态TiCl4,再用金属镁在高温下还原得到金属钛,同时生成MgCl2。
①MgCl2的熔沸点比TiCl4高得多,其原因是______。
②原子半径r(Cl)_____r(Mg),离子半径r(O2-)______r(Mg2+)(填“>”、“<”或“=”)。
(4)金属镍能与CO反应生成一种配合物Ni(CO)4(常温下为无色液体)。Ni(CO)4的固体属于_____晶体,Ni与CO之间的化学键称为__________,提供孤对电子的成键原子是_________。(填元素符号)
(5)一种钛镍合金的立方晶胞结构如图所示:
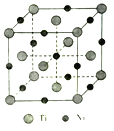
①该合金中Ti的配位数为________。
②若合金的密度为d g/cm3,晶胞边长a=________pm。(用含d的计算式表示)
查看答案和解析>>
科目: 来源: 题型:
【题目】下列事实不能用勒夏特列原理来解释的是
A. 将混合气中的氨气液化分离,有利于合成氨的反应
B. 用过量氮气与氢气反应可以提高氢气的转化率
C. 密闭容器中发生反应H2(g)+I2(g)![]() 2HI(g),增大压强时容器中颜色加深
2HI(g),增大压强时容器中颜色加深
D. 加压有利于SO2与O2反应生成SO3
查看答案和解析>>
科目: 来源: 题型:
【题目】现有ag某气体,它由双原子分子构成,它的摩尔质量为Mg/mol。若阿伏加德罗常数用NA表示,则:
(1)该气体的物质的量为_________mol。
(2)该气体所含原子总数为_____________个。
(3)该气体在标准状况下的体积为___________L。
(4)该气体溶于1 L水中(不考虑反应),其溶液中溶质的质量分数为_____________。
(5)该气体溶于水后形成VL溶液,其溶液的物质的量浓度为___________mol/L。
(6)下列所含分子数由多到少的排列顺序是____________(填写序号)。
A.标准状况下33. 6 L H2 B.所含电子的物质的量为4 mol的H2
C. 4℃时45 g H2O D.常温下,16gO2与14gN2的混合气体
E.含原子总数约为1.204×1024的NH3
查看答案和解析>>
科目: 来源: 题型:
【题目】某温度时,在2L恒容密闭容器中,X、Y、Z三种气态物质的变化曲线如图所示,关于其变化的一些说法正确的是
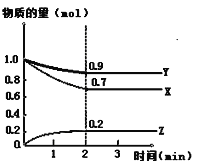
A. 用X表示该化学反应速率比用Y表示的要快
B. 该反应的化学方程式:3X+Y![]() 2Z
2Z
C. 若在3min后,把Z从反应体系中分离,平衡不移动
D. 反应开始至2min,Z的平均反应速率:0.1mol/(L·min)
查看答案和解析>>
科目: 来源: 题型:
【题目】某研究性学习小组为了了解HCl、NaHSO4、NaHCO3在水溶液中的电离情况,进行下列实验:
①分别测定了0.1 mol·L-1的HCl、NaHSO4、NaHCO3 溶液中H+的物质的量浓度,HCl溶液 中c(H+)=0.1 mol·L-1,NaHSO4溶液中c(H+)=0.1 mol·L-1,而NaHCO3溶液中H+的物 质的量浓度远远小于0.1 mol·L-1。
②取少量NaHSO4溶液于试管中,滴入BaCl2溶液有不溶于稀硝酸的白色沉淀生成。
③取少量NaHCO3溶液于试管中,滴入几滴BaCl2溶液无明显现象。
请根据实验结果回答下列问题:
(1)分别写出HCl、NaHSO4、NaHCO3在水溶液中的电离方程式:HCl:__________________________________________________;
NaHSO4:__________________________________________________;
NaHCO3:__________________________________________________。
(2)NaHSO4属于“酸”“碱”“盐”中的________________________。
(3)写出②中反应的化学方程式:_________________________________________________。
(4)若将NaHSO4与Ba(OH)2在溶液中按照物质的量之比1∶1混合,反应的离子方程式为__________________________________________________________________________。
(5)若将NaHSO4逐滴加入Ba(OH)2溶液中至Ba2+恰好完全沉淀,反应的离子方程式为_________________________________________________________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】请完成下列填空。
(1)现有21.6g由CO和CO2组成的混合气体,在标准状况下其体积为13.44L。该混合气体的平均摩尔质量为___________,该混合气体中含CO2的物质的量为__________mol。
(2)已知某氢氧化钠溶液VmL中含有N个氢氧根离子,求此氢氧化钠溶液的物质的量浓度_________。
(3)己知:在1升水中完全溶解有336升氯化氢(标准状况下),求标准状况下此氯化氢溶液中溶质的质量分数为_______________。(保留一位小数)。
查看答案和解析>>
科目: 来源: 题型:
【题目】化合物I(C11H12O3)是制备液晶材料的中间体之一,其分子中含有醛基和酯基。I可以用E和H在一定条件下合成:

已知以下信息:
①A的核磁共振氢谱表明其只有一种化学环境的氢;
②R--CH==CH2![]() R—CH2CH2OH;
R—CH2CH2OH;
③化合物F苯环上的一氯代物只有两种;
④通常在同一个碳原子上连两个羟基不稳定,易脱水形成羰基。
回答下列问题:
(1)A的化学名称为___________________。B分子中最多共面原子数为_________。
(2)F的结构简式为___________________。
(3) A生成B的化学方程式为________________________________该反应类型为___________。
(4)E、H生成I的化学方程式为____________________________________________。
(5)已知:J比I(C11H12O3)相对分子质量小14,J的同分异构体中能同时满足如下条件的共有__________种。
①苯环上只有两个取代基,
②既能发生银镜反应,又能与饱和NaHCO3溶液反应放出CO2。
(6)J的一个同分异构体发生银镜反应并酸化后核磁共振氢谱为三组峰,且峰面积比为2∶2∶1,写出J的这种同分异构体的结构简式_______________________________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】某未知溶液中已检验出含有离子Ca2+、NO3-,且pH=2。欲检验此溶液中是否大量存在以下6种离子:①ClO- ②NH4+ ③I- ④Fe2+ ⑤AlO2- ⑥Cl-,其中不必检验就能排除的离子是
A.②③⑤⑥ B.①③④⑤
C.①④⑤⑥ D.①②③④
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com