
科目: 来源: 题型:
【题目】进行化学实验时应强化安全意识。下列做法正确的是
A. 金属钠着火时使用泡沫灭火器灭火
B. 用试管加热碳酸氢钠固体时使试管口竖直向上
C. 蒸馏实验时向蒸馏瓶中放入几粒沸石(或碎瓷片)
D. 浓硫酸溅到皮肤上时立即用稀氢氧化钠溶液冲洗
查看答案和解析>>
科目: 来源: 题型:
【题目】韩国三星公司因为手机电池爆炸而屡屡曝光,电池的安全性和环保性再次被公众所重视。一种以引火性高的联氨(N2H4)为燃料的环保电池,工作时产生稳定无污染的物质,原理如图所示。下列说法正确的是

A.N极为电源负极,联氨从c口通入
B.负极上每消耗l mol N2H4,转移6 mol电子
C.正极的电极反应式为:O2+2H2O+4e![]() 4OH
4OH
D.可将联氨改进为引火性低、稳定性好的N2H4·H2O
查看答案和解析>>
科目: 来源: 题型:
【题目】某小组同学用一种铝铁合金为原料,模拟相关的工业生产,反应过程如图所示(部分产物和条件已略去),请回答:

(1)铁铝合金是一种高电磁性能合金,下列有关推测可能正确的是_____(填序号).
A.铁铝合金可由铁和铝熔融混合制成
B.铁铝合金的熔点高于铝和铁
C.铁铝合金硬度高于纯铝
(2)反应①中铝元素发生反应的离子方程式为_____.
(3)反应②的化学方程式为_____.
(4)反应③发生时观察到的现象是_____.
(5)反应④中的CO2不宜换成HCl,原因是_____.
(6)请分别举出固体A和B的一种用途_____、_____.
查看答案和解析>>
科目: 来源: 题型:
【题目】
环己烯是一种重要的有机合成原料。下图是以环己烯为原料进行多种有机物合成的路线:
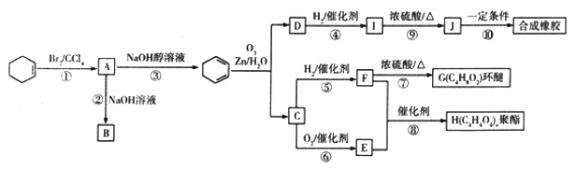
已知以下信息:
(ⅰ)其中F可以作内燃机的抗冻剂;
(ⅱ)J分子中无饱和碳原子;
(ⅲ) Rl—CH=CH—R2 ![]() R1—CHO+R2—CHO
R1—CHO+R2—CHO
回答下列问题:
(l)与① 反应类型相同的是________(填序号)。
(2)I生成J的化学方程式为______,反应⑩的生成物“合成橡胶”的结构简式为______。
(3)E的化学名称是___________。
(4)F的结构简式为___________,含有的官能团名称是___________。
(5)能与NaHCO3溶液反应放出CO2的B的同分异构体共有_______种,其中核磁共振氢谱有4 组峰,且峰面积比为1:1:4:6 的是___________(填结构简式)。
(6)参照上述合成路线,以2—戊烯(CH3CH=CHCH2CH3)为原料(其他无机试剂任选),设计制备乙二酸二乙酯的合成路线:___________。
查看答案和解析>>
科目: 来源: 题型:
【题目】砷为VA族元素,金属冶炼过程产生的含砷有毒废弃物需处理与检测。
Ⅰ.冶炼废水中砷元素主要以亚砷酸(H3AsO3)形式存在,可用化学沉降法处理酸性高浓度含砷废水,其工艺流程如下:

已知:①As2S3与过量的S2存在以下反应:As2S3(s)+3S2(aq)![]() 2
2![]() (aq);
(aq);
②亚砷酸盐的溶解性大于相应砷酸盐。
(1)亚砷酸中砷元素的化合价为________;砷酸的第一步电离方程式为_______________________。
(2)“一级沉砷”中FeSO4的作用是_____________________;“二级沉砷”中H2O2与含砷物质反应的化学方程式为_______________________。
(3)沉淀X为___________(填化学式)。
Ⅱ.冶炼废渣中的砷元素主要以As2S3的形式存在,可用古氏试砷法半定量检测(As的最低检出限为3.0×106 g)。
步骤1:取10 g废渣样品,粉碎后与锌粉混合,加入H2SO4共热,生成AsH3气体。
步骤2:将AsH3气体通入AgNO3溶液中,生成银镜和As2O3。
步骤3:取1 g废渣样品,重复上述实验,未见银镜生成。
(4)AsH3的电子式为_______________。
(5)步骤2的离子方程式为___________________________。
(6)固体废弃物的排放标准中,砷元素不得高于4.0×105 g·kg1,请通过计算说明该排放的废渣中砷元素的含量_______(填“符合”、“不符合”)排放标准,原因是_________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】碱式碳酸镍[Nix(OH)y(CO3)z·nH2O是一种绿色粉末晶体,常用作催化剂和陶瓷着色剂,300℃以上时分解生成3种氧化物。为确定其组成,某同学在实验室中进行了有关的实验探究。回答下列问题:

(l)甲、乙两装置可分别选取下列装置______、_______(填字母,装置可重复选取)。

(2)称取一定量的碱式碳酸镍样品,放入硬质玻璃管内;安装好实验仪器,检查装置气密性;加热硬质玻璃管,当装置C中__________(填实验现象)时,停止加热;打开活塞K,缓缓通入空气。其目的是_______________________。
(3)装置A的作用是_________,装置E的作用是_____________。
(4)实验前后测得下表所示数据:
装置B中样品质量/g | 装置C 质量/g | 装置D质量/g | |
实验前 | 3.77 | 132.00 | 41.00 |
实验后 | 2.25 | 133.08 | 41.44 |
已知碱式碳酸镍中Ni化合价为+2价,则该碱式碳酸镍的化学式为___________。
(5)采取上述实验装置进行该实验时,必须小心操作,且保证装置气密性良好,否则浓硫酸倒吸,可导致加热的硬质玻璃管炸裂。为防止浓硫酸倒吸入硬质玻璃管中,提出你的改进措施:______________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】工厂中用稀硫酸浸泡某矿石后的溶液中,除了含有大量硫酸外,还含有少量![]() 、Fe3+、
、Fe3+、![]() 、Cl。为除去杂质离子,部分操作流程如图:
、Cl。为除去杂质离子,部分操作流程如图:

请回答问题:
(1)用稀硫酸浸泡某矿石后的溶液中,硫酸的密度为4.9gL1,则该溶液中的pH约为 。
(2)![]() 在用稀硫酸浸泡某矿石后的溶液中以(NH4)2SO4和NH4Cl形式存在.现有一份(NH4)2SO4溶液,一份NH4Cl溶液,(NH4)2SO4溶液中c(
在用稀硫酸浸泡某矿石后的溶液中以(NH4)2SO4和NH4Cl形式存在.现有一份(NH4)2SO4溶液,一份NH4Cl溶液,(NH4)2SO4溶液中c(![]() )恰好是NH4Cl溶液中c(
)恰好是NH4Cl溶液中c(![]() )的2倍,则c[(NH4)2SO4]___________c(NH4Cl)(填:<、=或>)。
)的2倍,则c[(NH4)2SO4]___________c(NH4Cl)(填:<、=或>)。
(3)随着向废液中投入生石灰(忽略溶液温度的变化),溶液中![]() (填“增大”“减小”或“不变”)。
(填“增大”“减小”或“不变”)。
(4)投入生石灰调节pH到2~3时,大量沉淀主要成分为CaSO42H2O[含有少量Fe(OH)3],提纯CaSO42H2O的主要操作步骤:向沉淀中加入过量 ,充分反应后,过滤、洗涤、 。
(5)25℃,H3AsO4电离常数为K1=5.6×103,K2=1.7×107,K3=4.0×1012。当溶液中pH调节到8~9时,沉淀主要成分为Ca3(AsO4)2。
①pH调节到8左右Ca3(AsO4)2才开始沉淀的原因是 。
②Na3AsO4第一步水解的平衡常数数值为: 。
③已知:![]() +2I+2H+
+2I+2H+![]()
![]() +I2+H2O,SO2+I2+2H2O
+I2+H2O,SO2+I2+2H2O![]()
![]() +2I+4H+。上述两个反应中还原性最强的微粒是 。
+2I+4H+。上述两个反应中还原性最强的微粒是 。
查看答案和解析>>
科目: 来源: 题型:
【题目】将足量的CO2不断通入NaOH、Ca(OH)2、NaAlO2的混合溶液中〔已知NaAlO2与CO2反应生成Al(OH)3〕,则生成沉淀的物质的量与通入CO2的体积的关系可表示为( )
A.  B.
B. 
C.  D.
D. 
查看答案和解析>>
科目: 来源: 题型:
【题目】下列叙述中正确的是( )
A. 向NaHCO3溶液中滴加澄清石灰水,不会产生沉淀
B. 等质量NaHCO3和Na2CO3分别与足量盐酸反应,生成的CO2在同温同压下体积相同
C. 向Na2CO3溶液中缓慢通入等物质的量的HCl,生成的CO2与原Na2CO3的物质的量之比为1:2
D. 向Na2CO3饱和溶液中通入CO2,有晶体析出
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com