
科目: 来源: 题型:
【题目】判断一个化学反应是否属于氧化还原反应的方法是( )
A、观察是否发生了化合反应 B、观察是否有氧气参加反应
C、观察是否有单质参加反应 D、观察反应前后是否有元素的化合价发生变化
查看答案和解析>>
科目: 来源: 题型:
【题目】埋在地下的铸铁输油管道,在下列各种情况下,被腐蚀速率最慢的是
A. 在含铁元素较多的酸性土壤中 B. 在潮湿疏松的碱性土壤中
C. 在干燥致密不透气的土壤中 D. 在含碳粒较多,潮湿透气的中性土壤中
查看答案和解析>>
科目: 来源: 题型:
【题目】下列说法正确的是( )
A. Mg和Al都可以用电解法冶炼得到
B. Na2O和Na2O2与CO2反应产物相同
C. MgO和Al2O3均只能与酸反应,不能与碱反应
D. 根据丁达尔现象可以将分散系分为溶液、胶体和浊液
查看答案和解析>>
科目: 来源: 题型:
【题目】配位键是一种特殊的共价键,即共用电子对由某原子单方面提供和另一缺电子的粒子结合。如NH4+就是由NH3(氮原子提供电子对)和H+(缺电子)通过配位键形成的。据此,回答下列问题:
(1)下列粒子中可能存在配位键的是________。
A.CO2 B.H3O+ C.CH4 D.H2SO4
(2)硼酸(H3BO3)溶液呈酸性,试写出其电离方程式:___________________。
(3)科学家对H2O2结构的认识经历了较为漫长的过程,最初,科学家提出了种观点:
甲: 、乙:HOOH,式中O→O表示配位键,在化学反应中O→O键遇到还原剂时易断裂。化学家Baeyer和Villiyer为研究H2O2的结构,设计并完成了下列实验:a.将C2H5OH与浓H2SO4反应生成(C2H5)2SO4和水;b.将制得的(C2H5)2SO4与H2O2反应,只生成A和H2SO4;c.将生成的A与H2反应(已知该反应中H2做还原剂)。
、乙:HOOH,式中O→O表示配位键,在化学反应中O→O键遇到还原剂时易断裂。化学家Baeyer和Villiyer为研究H2O2的结构,设计并完成了下列实验:a.将C2H5OH与浓H2SO4反应生成(C2H5)2SO4和水;b.将制得的(C2H5)2SO4与H2O2反应,只生成A和H2SO4;c.将生成的A与H2反应(已知该反应中H2做还原剂)。
①如果H2O2的结构如甲所示,实验c中化学反应方程式为(A写结构简式)_____________________________________________________________。
②为了进一步确定H2O2的结构,还需要在实验c后添加一步实验d,请设计d的实验方案__________________________________________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】蒸馏是实验室制备蒸馏水的常用方法。
(1)图I是实验室制取蒸馏水的常用装置,图中明显的错误是_________________。

(2)仪器A的名称是_____________,仪器B的名称是______________。
(3)实验时A中除加入少量自来水外,还需加入少量__________,其作用是__________________。
(4)图II装置也可用于少量蒸馏水的制取(加热及固定仪器略),其原理与图I完全相同。该装置中使用的玻璃导管较长,其作用是 ______________________;烧杯中还应盛有的物质是______________________。

查看答案和解析>>
科目: 来源: 题型:
【题目】可逆反应NO2(g)+ CO(g) ![]() CO2(g)+ NO(g) 反应过 程中的能量变化如图所示,下列说法正确的是
CO2(g)+ NO(g) 反应过 程中的能量变化如图所示,下列说法正确的是
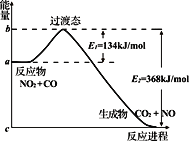
A. 1molNO2与1molCO混合经充分反应放热234 kJ
B. 若反应开始时加入催化剂, 则使E1 、E2 都变大
C. 正反应的活化能是134kJ/mol
D. 该反应的反应热⊿H = E2–E1
查看答案和解析>>
科目: 来源: 题型:
【题目】将一定量的SO2通入碘水中,分别进行下列实验,能证明SO2与碘发生氧化还原反应的是
操作 | 现象或结果 | |
A | 取混合溶液加入淀粉溶液 | 溶液变蓝 |
B | 取混合溶液加入BaCl2溶液 | 有白色沉淀 |
C | 测通入前后溶液的pH | pH减小 |
D | 取混合溶液加入AgNO3溶液 | 有黄色沉淀 |
A. A B. B C. C D. D
查看答案和解析>>
科目: 来源: 题型:
【题目】为验证氧化性Cl2>Fe3+> SO2,某小组用下图所示装置进行实验(夹持仪器和A中加热装置已略,气密性已检验)。
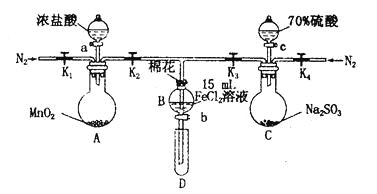
实验过程:
I.打开弹簧夹K1~K4,通入一段时间N2,再将T型导管插入B中,继续通入N2,然后关闭K1、K3、K4。
Ⅱ.打开活塞a,滴加一定量的浓盐酸,给A加热。
Ⅲ.当B中溶液变黄时,停止加热,关闭K2。
Ⅳ.打开活塞b,使约2 mL的溶液流入D试管中,检验其中的离子。
V.打开K3和活塞c,加入70%的硫酸,一段时间后关闭K3。
Ⅵ.更新试管D,重复过程Ⅳ,检验B溶液中的离子。
(1)过程I的目的是____。
(2)检验B中溶液是否还有Fe2+的方法之一是:取少量B中溶液于试管中,滴加几滴含有+3价铁元素的配合物溶液,会产生蓝色沉淀.写出该反应的离子方程式____ 。
(3)若向第III步B中的黄色溶液中通入H2S气体,会观察到有淡黄色沉淀生成,写出该反应的离子方程式____。
(4)若将制取的SO2通入硫酸酸化的高锰酸钾溶液可使溶液褪色,其反应的化学方程式为________。
(5)甲、乙、丙三位同学分别完成了上述实验,结论如下表所示。他们的检测结果一定不能够证明氧化性Cl2>Fe3+>SO2的是____(填“甲”、“乙”或“丙”)。
过程Ⅳ,B溶液中含有的离子 | 过程Ⅵ,B溶液中 含有的离子 | |
甲 | 有Fe3+无Fe2+ | 有SO42- |
乙 | 既有Fe3+又有Fe2+ | 有SO42- |
丙 | 有Fe3+无Fe2+ | 有Fe2+ |
(6)将B中的FeCl2溶液换成100 mLFeBr2溶液并向其中通入1.12 LCl2(标准状况下),若溶液中有1/2的Br一被氧化成单质Br2,则原FeBr2溶液中FeBr2的物质的量浓度为____ mol/L。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com