
科目: 来源: 题型:
【题目】25℃条件下,向10 mL 0.1 mol·Lˉ1的HR溶液中逐滴滴入0.1 mol·Lˉ1的NH3·H2O溶液,所得溶液pH及导电性变化如图。下列分析不正确的是( )
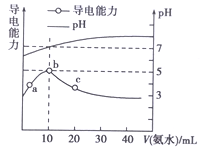
A. a~b点导电能力增强,说明HR为弱酸
B. b点溶液pH=7说明NH4R没有发生水解
C. c点溶液存在c(NH4+)>c(Rˉ)、c(OHˉ)>c(H+)
D. b~c任意点溶液均有c(H+)·c(OHˉ)=KW=1.0×10ˉ14
查看答案和解析>>
科目: 来源: 题型:
【题目】[2017北京]某小组在验证反应“Fe+2Ag+=Fe2++2Ag”的实验中检测到Fe3+,发现和探究过程如下。
向硝酸酸化的0.05 mol·L-1硝酸银溶液(pH≈2)中加入过量铁粉,搅拌后静置,烧杯底部有黑色固体,溶液呈黄色。
(1)检验产物
①取出少量黑色固体,洗涤后,_______(填操作和现象),证明黑色固体中含有Ag。
②取上层清液,滴加K3[Fe(CN)6]溶液,产生蓝色沉淀,说明溶液中含有_______________。
(2)针对“溶液呈黄色”,甲认为溶液中有Fe3+,乙认为铁粉过量时不可能有Fe3+,乙依据的原理是___________________(用离子方程式表示)。针对两种观点继续实验:
①取上层清液,滴加KSCN溶液,溶液变红,证实了甲的猜测。同时发现有白色沉淀产生,且溶液颜色深浅、沉淀量多少与取样时间有关,对比实验记录如下:
序号 | 取样时间/min | 现象 |
ⅰ | 3 | 产生大量白色沉淀;溶液呈红色 |
ⅱ | 30 | 产生白色沉淀;较3 min时量少;溶液红色较3 min时加深 |
ⅲ | 120 | 产生白色沉淀;较30 min时量少;溶液红色较30 min时变浅 |
(资料:Ag+与SCN-生成白色沉淀AgSCN)
② 对Fe3+产生的原因作出如下假设:
假设a:可能是铁粉表面有氧化层,能产生Fe3+;
假设b:空气中存在O2,由于________(用离子方程式表示),可产生Fe3+;
假设c:酸性溶液中![]() 具有氧化性,可产生Fe3+;
具有氧化性,可产生Fe3+;
假设d:根据_______现象,判断溶液中存在Ag+,可产生Fe3+。
③ 下列实验Ⅰ可证实假设a、b、c不是产生Fe3+的主要原因。实验Ⅱ可证实假设d成立。
实验Ⅰ:向硝酸酸化的________溶液(pH≈2)中加入过量铁粉,搅拌后静置,不同时间取上层清液滴加KSCN溶液,3 min时溶液呈浅红色,30 min后溶液几乎无色。
实验Ⅱ:装置如图。其中甲溶液是________,操作及现象是________________。

(3)根据实验现象,结合方程式推测实验ⅰ~ⅲ中Fe3+浓度变化的原因:______。
查看答案和解析>>
科目: 来源: 题型:
【题目】下列叙述中,正确的是( )
A. 12g碳所含的原子数就是阿伏加德罗常数
B. 1molHCl的质量是36.5 g·mol-1
C. Cl2的摩尔质量等于它的相对分子质量
D. 摩尔是表示物质的量的单位,每摩尔物质含有阿伏加德罗常数个微粒
查看答案和解析>>
科目: 来源: 题型:
【题目】为了提纯下列物质(括号内为杂质),除杂试剂和分离方法均正确的是
选项 | 待提纯的物质 | 除杂试剂 | 分离方法 |
A | 乙醇(乙醇钠) | Na | 过滤 |
B | 溴苯(Br2) | 苯 | 萃取 |
C | 苯甲酸(NaCl) | 水 | 重结晶 |
D | 苯(苯酚) | NaOH溶液 | 蒸馏 |
A. A B. B C. C D. D
查看答案和解析>>
科目: 来源: 题型:
【题目】常温下,现用98%浓硫酸(ρ=1.84 g/mL)配制200 mL氢离子浓度为1.00 mol/L的稀硫酸,下列有关的说法正确的是( )
A. 需要量取浓硫酸的体积为21.7 mL
B. 将浓硫酸沿玻璃棒缓慢的加入容量瓶中
C. 若洗涤装浓硫酸的量筒并转移到容量瓶中,则浓度偏大
D. 在量取浓硫酸时,若皮肤上沾上浓硫酸,应立即用大量水冲洗,并涂上硼酸。
查看答案和解析>>
科目: 来源: 题型:
【题目】某温度下,质量为95 g的氯化镁溶解在0.2 L水中(水的密度近似为1 g/mL)恰好得到氯化镁的饱和溶液,所得溶液的密度为ρ g/mL,物质的量浓度为c mol/L,溶解度为s,NA表示阿伏加德罗常数的值,则下列叙述中正确的是( )
A. 所得溶液中含有NA个氯化镁分子
B. 所得溶液的物质的量浓度为5 mol/L
C. 所得溶液的溶解度可表示为9500 c/(1000ρ-95c)
D. 所得溶液的质量分数可表示为95 ρ/(1000c)
查看答案和解析>>
科目: 来源: 题型:
【题目】下列说法错误的是( )
A. 蔗糖和麦芽糖水解的最终产物都是葡萄糖
B. 用灼烧的方法可以区分蚕丝和人造纤维
C. 植物油氢化过程中发生了加成反应
D. 棉、麻、羊毛都属于天然高分子化合物
查看答案和解析>>
科目: 来源: 题型:
【题目】乌洛托品在合成、医药、染料等工业中有广泛用途,其结构式如图所示。将甲醛水溶液与氨水混合蒸发可制得乌洛托品。若原料完全反应生成乌洛托品,则甲醛与氨的物质的量之比为( )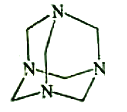
A. 1:1 B. 2:3 C. 3:2 D. 2:1
查看答案和解析>>
科目: 来源: 题型:
【题目】【山西省实验中学2017届下学期模拟热身】五种短周期元素A、B、C、D、E的性质及结构信息如下:
① 原子半径A>B>C>D>E;
② 五种元素之间形成的常见的四种分子如下:
甲 | 乙 | 丙 | 丁 | |
比例模型 |
|
|
|
|
组成元素 | D、E | B、E | A、D、E | C、E |
电子总数 | 10 | 18 | 26 | 10 |
请根据上述信息回答下列问题:
(1)A元素的单质与物质甲发生反应的离子方程式为_______,其化学反应平衡常数的表达式为___。
(2)戊与乙互为同系物,有五种同分异构体,戊的分子式为_____,己与乙具有相同的电子数,与甲含有的元素种类相同,己分子的结构式为_______。
(3)C与E元素组成的CE3与液氮可组成燃料电池,产物均为无污染的物质,可用于驱动潜艇,燃料电池装置如下图所示。该电池的负极反应式为_____。电池工作时OH-向_____移动(填“正极”或“负极”)。

(4)B与D组成的一种物质在自然界中可循环,循环时其与CaCO3反应。已知Ksp(CaCO3)=2.8×10-9,现将CaCl2溶液与Na2CO3溶液等体积混合,若Na2CO3溶液的浓度为2×10-4mol/L,则生成沉淀的最小浓度为__________(忽略混合前后溶液的体积变化)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com