
科目: 来源: 题型:
【题目】【淄博市2017届仿真模拟(打靶卷)】CO常用于工业冶炼金属。在不同温度下CO还原四种金属氧化物达平衡后气体中lg![]() 与温度(t)的关系曲线如右图。下列说法正确的是
与温度(t)的关系曲线如右图。下列说法正确的是
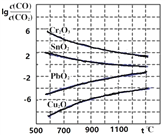
A.通过增高反应炉的高度,延长矿石和CO接触的时间,能减少尾气中CO的含量
B.CO不适宜用于工业冶炼金属Cr
C.CO还原PbO2的反应ΔH>0
D.工业冶炼金属Cu时,高温有利于提高CO的转化率
查看答案和解析>>
科目: 来源: 题型:
【题目】实验室里需要纯净的氯化钠晶体,但现在只有混有硫酸钠、碳酸氢铵的氯化钠。某学生设计了如下方案:

![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
请回答下列问题:
(1)操作①加热的目的是________________,发生反应的化学方程式为
____________________________________________________________________。
(2)操作②除用BaCl2溶液外,还可用________。
(3)操作②,判断SO![]() 已除尽的方法是__________________________________。
已除尽的方法是__________________________________。
(4)操作③的目的是____________,不先过滤后再加Na2CO3溶液的理由是
__________________________________________________________________。
(5)操作④的名称是______________,应在________(填仪器名称)中进行。
查看答案和解析>>
科目: 来源: 题型:
【题目】下列实验能达到相应目的是( )
选项 | A | B | C | D |
实验 过程 |
|
|
|
|
实验 目的 | 将乙二醇(HOCH2CH2OH)转化为乙二酸(H2C2O4) | 比较氯化铁和二氧化锰对H2O2分解反应的催化效果 | 证明稀硝酸与铜反应时表现出氧化性 | 用SO2与Ba(NO3)2反应获得BaSO3沉淀 |
A. A B. B C. C D. D
查看答案和解析>>
科目: 来源: 题型:
【题目】当氢氧化镁固体在水中达到溶解平衡 Mg(OH)2(s)![]() Mg2+(aq)+2OH-(aq),为使固体的量减少,可加入少量的( )
Mg2+(aq)+2OH-(aq),为使固体的量减少,可加入少量的( )
A. NH3 ·H2O B. NaOH C. MgSO4 D. NaHSO4
查看答案和解析>>
科目: 来源: 题型:
【题目】环境监察局常用“定电位”NOx传感器来监测化工厂的氮氧化物气体是否达到排放标准,其工作原理如图所示。下列说法不正确的是( )

A. “对电极”是负极
B. “工作电极”上发生的电极反应为NO2+2e-+2H+═NO+H2O
C. 传感器工作时H+由工作电极移向对电极
D. 对电极的材料可能为活泼金属锌
查看答案和解析>>
科目: 来源: 题型:
【题目】关于溶液的pH值,下列说法正确的是
A. pH=0的溶液呈中性 B. 某强碱溶液的浓度为0.01 mol/L,该溶液的pH值一定为12
C. 溶液pH值越大,氢离子浓度越大 D. 酸性溶液中,氢离子浓度一定大于氢氧根浓度
查看答案和解析>>
科目: 来源: 题型:
【题目】现有以下几种措施:
①对燃烧煤时产生的尾气进行除硫处理;②少用原煤作燃料;③燃煤时鼓入足量空气;④开发清洁能源。其中能减少酸雨产生的措施是
A.①②③ B.②③④ C.①②④ D.①③④
查看答案和解析>>
科目: 来源: 题型:
【题目】半水煤气是工业合成氨的原料气,其主要成分是H2、CO、CO2、N2和H2O (g)。半水煤气经过下列步骤转化为合成氨的原料。完成下列填空:
![]()
(1)半水煤气含有少量硫化氢。将半水煤气样品通入_____________________溶液中(填写试剂名称),出现_______________,可以证明有硫化氢存在。
(2)写出半水煤气在铜催化下实现CO变换的反应方程式_____________________;若半水煤气中V(H2): V(CO): V(N2)=9:7:4,经CO变换后的气体中:V(H2): V(N2)=___。
(3)碱液吸收法是脱除二氧化碳的方法之一。有一吸收了二氧化碳的氢氧化钠溶液,为测定其溶液组成,采用双指示剂法进行滴定。
步骤:用移液管量取V0 mL的该溶液于锥形瓶中,先滴入1-2滴酚酞做指示剂,滴定达到终点时用去c molL-1的标准盐酸溶液Vl mL,此时再向溶液中滴入1-2滴_____做指示剂,达到滴定终点时又用去V2 mL标准盐酸溶液。
第二次滴定达到终点时的现象是_______________________________。
数据处理:通过Vl和V2的相对大小可以定性也可定量判断溶液的组成。
若V1>V2,写出此时的溶质的化学式_______________。
若2V1=V2,写出此时溶液中离子浓度由大到小的顺序_________________。
讨论:若V1<V2,在第一次滴定时未用标准盐酸润洗酸式滴定管,第二次滴定前发现并纠正了错误,则_______________(填化学式)浓度偏大。
查看答案和解析>>
科目: 来源: 题型:
【题目】铁及其化合物在日常生产生活中用途广泛。利用FeSO4制备还原铁粉的工业流程如下:
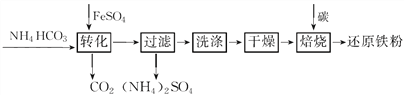
实验室中可用FeSO4(用铁粉和稀硫酸反应制得)和NH4HCO3在如下装置模拟上述流程中的“转化”环节。
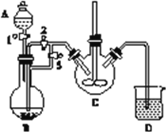
(1)装置A的名称是________,装置B中盛放的试剂是________,NH4HCO3盛放在装置________中。
(2)实验过程中,欲将生成的FeSO4溶液和NH4HCO3溶液混合制FeCO3沉淀,操作方法是________________,发生主要反应的离子方程式为_____________________。FeSO4溶液要现用现配制的原因是____________,检验久置的FeSO4是否变质的方法是______________。
(3)干燥过程主要目的是脱去游离水,过程中会有少量FeCO3在空气中被氧化为FeOOH,该反应的化学方程式为____________________________,取干燥后的FeCO3样品12.49 g,与碳混合后焙烧,最终得到还原铁粉6.16 g,计算样品中杂质FeOOH的质量:________g。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com