
科目: 来源: 题型:
【题目】化学学习中使用数轴的表示方法可起到直观、形象的效果,下列表达中不正确的是( )
A. 常温下溶液的pH与酸碱性的关系: ![]()
B. Fe在Cl2中的燃烧产物: 
C. 硫的化合物中化合价与其氧化性、还原性的关系: 
D. 氨水与SO2反应后溶液中的铵盐: 
查看答案和解析>>
科目: 来源: 题型:
【题目】酸性高锰酸钾溶液是常见的氧化剂。
实验室需要480mL浓度为0.12mol/L的KMnO4溶液和500mL浓度为0.5mol/L的H2SO4溶液。根据两种溶液的配制情况回答下列问题。
(1)在下图所示仪器中,配制上述溶液肯定不需要的是____(填序号),除图中已有仪器外,配制上述溶液还需要的玻璃仪器是________

(2)在容量瓶的使用方法中,下列操作不正确的是(填序号)_______________
A.使用容量瓶前检验是否漏水
B.配制KMnO4溶液时,把称好的KMnO4固体用纸条小心倒入容量瓶中,缓慢加水至接近刻度线1~2cm处,用胶头滴管加蒸馏水至刻度线。
C.配制H2SO4溶液时,容量瓶用蒸馏水选净后,还要用0.5mol/LH2SO4溶液润洗,方可使用。
D.盖好瓶塞,用食指顶住瓶塞,另一只手托住瓶底,把容量瓶反复倒转多次,摇匀。
(3)根据计算用托盘天平称取KMnO4固体的质量为________
(4)配制硫酸溶液过程中,下列操作会引起结果偏高的是(填序号)______________
A.未洗涤烧杯、玻璃棒
B.未冷却至室温就转移到容量瓶定容
C.定容时仰视刻度线
D.量筒量取浓硫酸仰视刻度线。
查看答案和解析>>
科目: 来源: 题型:
【题目】下列叙述正确的是
A. 常温常压下,4.6gNO2气体约含有1.81×1023个原子
B. 标准状况下,80gSO3所占的体积约为22.4L
C. 标准状况下,22.4LCCl4中含有的CCl4分子数为NA
D. 标准状况下,22.4L氢气与足量氧气反应,转移的电子数为1NA
查看答案和解析>>
科目: 来源: 题型:
【题目】下列解释事实的方程式不正确的是
A. 用湿润的淀粉—KI试纸检验Cl2: Cl2+2I-= 2 Cl-+I2
B. 工业固氮:N2+3H2![]() 2NH3
2NH3
C. 用FeCl3溶液腐蚀铜质线路板:2Fe3++Cu=2Fe2++Cu2+
D. 铝热法焊接铁轨:2Fe+Al2O3![]() 2Al+Fe2O3
2Al+Fe2O3
查看答案和解析>>
科目: 来源: 题型:
【题目】锌—空气电池是金属空气电池的一种,电解质溶液为KOH溶液时,反应为:2Zn+O2+4OH-+2H2O=2Zn(OH)42-。下列有关说法正确的是
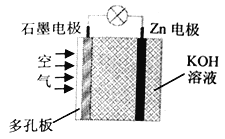
A. 石墨电极上发生氧化反应 B. 正极附近溶液的pH不断减小
C. OH-由锌电极移向石墨电极 D. Zn 电极上发生反应:Zn-2e-+4OH-=Zn(OH)42-
查看答案和解析>>
科目: 来源: 题型:
【题目】工业上利用硫铁矿烧渣(主要成分为Fe3O4、Fe2O3、FeO、SiO2)为原料制备高档颜料——铁红(Fe2O3),具体生产流程如下:

试回答下列问题:
(1)“酸溶”过程中Fe3O4发生反应的离子反应方程式为________________________;
(2)实验室实现“步骤Ⅱ”中分离操作所用的玻璃仪器有_______、玻璃棒和烧杯等;步骤Ⅳ中应选用_______试剂调节溶液的pH(填字母编号)。
A.稀硝酸 B.氢氧化钠溶液 C.高锰酸钾溶液 D.氨水
(3)检验步骤Ⅲ已经进行完全的试剂是_____________________;
(4)步骤Ⅴ的反应温度一般需控制在35℃以下,其目的是_________________________;
(5)步骤Ⅵ中发生反应的化学反应方程式为_____________________________;
(6)欲测定硫铁矿矿渣中Fe元素的质量分数,称取ag样品,充分“酸溶”、“水溶”后过滤,向滤液中加入足量的H2O2,充分反应后加入NaOH溶液至不再继续产生沉淀,经过滤、洗涤、灼烧至固体恒重,冷却后称得残留固体bg,测得该样品中Fe元素的质量分数为__________。
查看答案和解析>>
科目: 来源: 题型:
【题目】探究无机盐X(仅含三种短周期元素)的组成和性质,设计并完成如下实验:
请回答:
(1)X的化学式是____。
(2)白色粉末溶于氢氧化钠溶液的离子方程式是____。
(3)高温条件下白色粉末与焦炭发生置换反应,写出该反应的化学方程式____。
查看答案和解析>>
科目: 来源: 题型:
【题目】在某体系内有反应物和生成物5种物质:H2S、S、FeCl3、FeCl2、HCl.已知H2S为反应物,则另一反应物是( )
A. FeCl3 B. FeCl2 C. S D. HCl
查看答案和解析>>
科目: 来源: 题型:
【题目】碳铵是一种较常使用的化肥,它在常温下易分解.某化学兴趣小组对碳铵的成分存在疑问,时行了如下探究.
【定性实验】检验溶液中的阴、阳离子
取少量固体放入试管中,加入盐酸,把生成的气体通入澄清石灰水中,有白色沉淀生成.再另取少量碳铵放入试管中,加入浓NaOH溶液,加热,用湿润的红色石蕊试纸检验生成的气体,石蕊试纸变蓝色.
(1)根据实验现象,推测碳铵中所含有阴离子可能是 和 ;
(2)根据实验现象,碳铵与足量NaOH溶液加热反应的离子方程式可能是 ;
【定量试验】测定碳铵中C元素和N元素质量比.该兴趣小组准确称取ag碳铵,加热使之分解,并把产物通入碱石灰中,如图1所示.

(3)碳铵固体应放在A 中进行加热.
A.试管 | B.蒸发皿 | C.烧瓶 | D.坩埚 |
(4)从安全的角度考虑,尾气处理的装置可以选用如图2 ;
(5)若灼烧后没有固体残余,称量U形管在实验前后的质量差为bg.由此测得N元素的质量是 g.
(6)为了测定碳铵中碳元素的质量,他们设计的实验方案是将ag碳铵完全溶解于水,加入过量BaCl2,然后测定生成沉淀质量.请你评价该方案是否合理; (填“合理”“不合理”),理由是 .
查看答案和解析>>
科目: 来源: 题型:
【题目】已知氯化氢极易溶于水,标准状况下,1体积的水可以溶解500体积的氯化氢(HCl)气体,氯化氢的水溶液即为盐酸。
实验室现有质量分数为36.5%、密度为1.19gcm﹣3的浓盐酸,若用该浓盐酸配制0.4molL﹣1的稀盐酸220mL,试回答下列问题:
(1)配制该稀盐酸时,应选用的容量瓶的容积为(______).
A. 100mL B. 220mL C. 250mL D. 500mL
(2)计算需要____mL的浓盐酸,
(3)在量取浓盐酸后,进行了下列操作:
①待稀释盐酸的温度与室温一致后,沿玻璃棒注入容量瓶中.
②往容量瓶中加蒸馏水至液面离容量瓶刻度线1~2cm时,改用胶头滴管加蒸馏水,使溶液的液面与瓶颈的刻度标线相切.
③在盛蒸馏水的烧杯中注入盐酸,并用玻璃棒搅动,使其混合均匀.
④用蒸馏水洗涤烧杯和玻璃棒2至3次,并将洗涤液全部注入容量瓶.
上述操作中,正确的顺序是(填序号)_____________。
(4)在下述配制过程中,配制的稀盐酸浓度将会偏高的是_________________;使浓度会偏低的是 _________________________。(填序号)
①未转移溶液前容量瓶中有少量的蒸馏水
②量取浓盐酸时俯视刻度线
③量取浓盐酸后用蒸馏水洗涤量筒
④若未用蒸馏水洗涤烧杯内壁或未将洗涤液注入容量瓶
⑤定容时俯视刻度线
(5)在标准状况下,用一支收集满HCl气体的试管倒立在水槽中,水倒吸当充满试管时用塞子堵住试管口竖立(假设溶液不泄漏),则该溶液的溶质的物质的量浓度为_________________(保留两位小数)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com