
科目: 来源: 题型:
【题目】将两份等质量的铝粉分别加入体积均为100mL,物质的量浓度均为2mol/L 的硫酸和氢氧化钠溶液中,充分反应后,生成相同条件下的氢气体积比为4∶5,则加入的每份铝粉质量为( )
A. 3.6g B. 4.5g C. 5.4g D. 6.3g
查看答案和解析>>
科目: 来源: 题型:
【题目】M 转化为N 分两步完成:①M(g)+Q(s) ![]() R(s) ΔH1>0; ②M(g)+R(s)
R(s) ΔH1>0; ②M(g)+R(s) ![]() N(g)+Q(s) ΔH2<0。
N(g)+Q(s) ΔH2<0。
转化过程中的能量变化如图所示,下列说法正确的是

A. 反应②的逆反应的活化能为 E4 kJ·mol-1
B. 反应①的正反应的活化能一定大于 ΔH1
C. R 是该反应的催化剂
D. 2M(g) ![]() N(g)的 ΔH=(E5-E1) kJ·mol-1
N(g)的 ΔH=(E5-E1) kJ·mol-1
查看答案和解析>>
科目: 来源: 题型:
【题目】手持技术的氧电化学传感器可用于测定O2含量.下图为某种氧电化学传感器的原理示意图,已知在测定O2含量过程中,电解质溶液的质量保持不变。一定时间内,若通过传感器的待测气体为a L(标准准状况),某电极增重了bg。下列说法正确的是

A. Pt上发生氧化反应 B. Pb上的电极反应式为4OH--4e-=O2↑+2H2O
C. 反应过程中转移OH-的物质的量为0.25bmol D. 待测气体中氧气的体积分数为0.7b/a
查看答案和解析>>
科目: 来源: 题型:
【题目】氯酸钾和浓盐酸之间有下列反应:2KClO3 + 4HCl(浓)== 2 KCl + Cl2↑+ 2ClO2 + 2H2O。
(1)该反应中发生还原反应的物质是__________。氧化产物是___________。
(2)用双线桥标出方程式中的电子得失___________。
2KClO3 + 4HCl(浓)== 2 KCl + Cl2↑+ 2ClO2 + 2H2O
(3)当有0.2mol电子发生转移时,生成的氯气的体积为_____L(标准状况)。被氧化的HCl的物质的量为____mol。
(4)若分别用①KMnO4(还原产物是Mn2+)②MnO2(还原产物是Mn2+)③Ca(ClO)2(还原产物是Cl2)氧化浓盐酸制备氯气,当浓盐酸足量且这三种氧化剂的物质的量相同时,生成氯气的物质的量最少的是________。
查看答案和解析>>
科目: 来源: 题型:
【题目】甲醇是一种很好的燃料,工业上一般在恒容密闭容器中可以采用下列反应合成甲醇:
CO(g)+2H2(g)![]() CH3OH(g) ΔH
CH3OH(g) ΔH
(1)判断反应达到平衡状态的依据是(填字母序号, 下同)__________。
A.生成CH3OH的速率与消耗CO的速率相等
B.混合气体的密度不变
C.混合气体的平均相对分子质量不变
D.CH3OH、CO、H2的浓度都不再变化
(2)下表所列数据是反应在不同温度下的化学平衡常数(K)。
温度 | 250 °C | 300 °C | 350 °C |
K | 2.041 | 0.270 | 0.012 |
①由表中数据判断ΔH__________0(填”>”“< “或”=“);
②某温度下,将2 mol CO和6 mol H2充入2 L 的密闭容器中,充分反应后,达到平衡时测得c(CO)=
0.2 mol L1,则CO的转化率为_______,此时的温度为______________。
(3)要提高CO的转化率,可以采取的措施是_______。
a.升温 b.加入催化剂
c.增加CO的浓度 d.加入H2加压
e.加入惰性气体加压 f.分离出甲醇
(4)300 °C,一定的压强下,5mol CO与足量H2在催化剂的作用下恰好完全反应变化的热量为454kJ。在该温度时,在容积相同的3个密闭容器中,按不同方式投入反应物,保持恒温、恒容,测得反应达到平衡时的有关数据如下:
容器 | 甲 | 乙 | 丙 | |
反应物投入量 | 1 mol CO、 2 mol H2 | 1 mol CH3OH | 2 mol CH3OH | |
平衡时数据 | CH3OH的浓度 / (mol L1) | c1 | c2 | c3 |
反应的能量变化 | a kJ | b kJ | c kJ | |
体系压强/ Pa | p1 | p2 | p3 | |
反应物的转化率 | α1 | α2 | α3 | |
下列说法正确的是_________。
A.2 c1>c3 B.a+b<90.8
C.2p2 <p3 D.α1 +α3<l
(5)为了寻找合成甲醇的温度和压强的适宜条件, 某同学设计了三组实验,部分实验条件已经填在下面实验设计表中。
实验编号 | T/℃ | n(CO)/n(H2) | p/MPa |
1 | 150 | 1/3 | 0.1 |
2 | a | 1/3 | 5 |
3 | 350 | b | 5 |
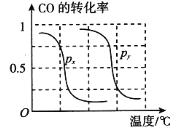
①则上表中剩余的验条件数据a=_________,b=_________。
②根据反应的特点,上图是在压强分别为0.1 MPa和5 MPa下CO的转化率随温度变化的曲线图,请指明图中的压强px=_________MPa。
查看答案和解析>>
科目: 来源: 题型:
【题目】下列对化学知识概括合理的是
A. 酸性氧化物都是非金属氧化物
B. 一种元素可能有多种氧化物,但同种化合价只对应一种氧化物
C. 丁达尔效应可用于区别溶液与胶体,云、雾均能产生丁达尔效应
D. 熔融状态能导电的物质一定是离子化合物
查看答案和解析>>
科目: 来源: 题型:
【题目】H2与ICl的反应分①、②两步进行,其能量曲线如下图所示,下列有关说法错误的是( )

A.反应①、反应②均为放热反应
B.反应①、反应②均为氧化还原反应
C.反应①比反应②的速率慢,与相应正反应的活化能无关
D.反应①、反应②的焓变之和为△H=﹣218kJmol﹣1
查看答案和解析>>
科目: 来源: 题型:
【题目】根据题目信息完成下列方程式。
(1)已知硫酸铅(PbSO4)不溶于盐酸也不溶于硝酸,但可溶于醋酸铵(CH3COONH4)溶液中形成无色溶液,其化学方程式为PbSO4 + 2CH3COONH4 = (CH3COO)2Pb + (NH4)2SO4。当在(CH3COO)2Pb溶液中通入H2S气体时,有黑色PbS沉淀生成,则此反应的离子方程式为__________________.
(2)钛(Ti)因为具有神奇的性能越来越引起人们的关注。地壳中含钛铁矿石之一是金红石(TiO2),目前大规模生产的方法是:
第一步:金红石、炭粉混合,在高温条件下,通入Cl2制得TiCl4和一种可燃气体,该反应的化学方程式为:____________________________________________;
第二步:在氩气的气氛中,用过量的镁在加热条件下与TiCl4反应制得金属钛。写出此反应的化学方程式:____________________________________________。
(3)用100mL 0.1mol/L的NaOH溶液吸收224mLCO2气体(标准状况),恰好完全吸收。再将所得溶液加入100mL 0.1mol/L氢氧化钙溶液中。请写出所得溶液与氢氧化钙溶液反应的离子方程式:_____________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】下列关于苯的叙述中错误的是( )
A. 苯的硝化反应是取代反应
B. 苯中加入酸性高锰酸钾溶液,振荡静置后下层液体为紫色
C. 78 g苯中含有C===C双键的数目为3NA
D. 在一定条件下,苯能与氢气发生加成反应
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com