
科目: 来源: 题型:
【题目】如图“→”表示一种金属能把另一种金属从其盐溶液中置换出来,则甲、乙、丙三种金属的活泼性由强到弱的顺序是( ) 
A.甲、乙、丙
B.乙、丙、甲
C.丙、甲、乙
D.甲、丙、乙
查看答案和解析>>
科目: 来源: 题型:
【题目】含有相同质子数和电子数的两种微粒之间的关系不正确的是:
A. 它们可能是同位素 B. 可能是不同的分子
C. 可能是不同的离子 D. 可能是一种分子和一种离子
查看答案和解析>>
科目: 来源: 题型:
【题目】为有效控制雾霾,各地积极采取措施改善大气质量,研究并有效控制空气中的氮氧化物、碳氧化物的含量显得尤为重要。
I.氮氧化物研究
(1)一定条件下,将2molNO与2molO2置于恒容密闭容器中发生反应2NO(g)+O2(g)![]() 2NO2(g),下列各项能说明反应达到平衡状态的是 ________________(填字母代号) 。
2NO2(g),下列各项能说明反应达到平衡状态的是 ________________(填字母代号) 。
a.体系压强保持不变 b.混合气体颜色保持不变
c.NO和O2的物质的量之比保持不变 d.每消耗1 molO2同时生成2 molNO2
(2)汽车内燃机工作时会引起N2和O2的反应:N2 +O2![]() 2NO,是导致汽车尾气中含有NO的原因之一。在T1、T2温度下,一定量的NO发生分解反应时N2的体积分数随时间变化如右图所示,根据图像判断反应N2(g)+O2(g)
2NO,是导致汽车尾气中含有NO的原因之一。在T1、T2温度下,一定量的NO发生分解反应时N2的体积分数随时间变化如右图所示,根据图像判断反应N2(g)+O2(g)![]() 2NO(g)的△H__________0(填“>”或“<”)。
2NO(g)的△H__________0(填“>”或“<”)。

Ⅱ.碳氧化物研究
(1)体积可变(活塞与容器之间的摩擦力忽略不计)的密闭容器如右图所示,现将3molH2和2molCO放入容器中,移动活塞至体积V为2L,用铆钉固定在A、B点,发生合成甲醇的反应如下:CO(g)+2H2(g)![]() CH3OH(g)。
CH3OH(g)。

测定不同条件、不同时间段内的CO的转化率,得到如下数据:
T(℃) | 10min | 20min | 30min | 40min |
T1 | 20% | 55% | 65% | 65% |
T2 | 35% | 50% | a1 | a2 |
①根据上表数据,请比较T1_________T2(选填“>”、“<”或“=”);T2℃下,第30min 时,a1=________,该温度下的化学平衡常数为__________________。
②T2℃下,第40min时,拔去铆钉(容器密封性良好)后,活塞没有发生移动,再向容器中通入6molCO,此时v(正)________v(逆)(选填“>”、“<”或“=”)。
(2)一定条件下可用甲醇与CO反应生成醋酸消除CO污染。常温下,将a mol/L的醋酸与b mol/L Ba(OH)2溶液等体积混合(混合后溶液体积变化忽略不计),充分反应后,溶液中存在2c(Ba2+)=c(CH3COO-),则根据溶液中的电荷平衡可知,溶液的pH=___________,则可以求出醋酸的电离常数Ka =____________ (用含a和b的代数式表示)。
查看答案和解析>>
科目: 来源: 题型:
【题目】某温度下,在一定体积的恒容密闭容器中进行可逆反应:X(g)+Y(g![]() Z(g) + W(s) △H>0,下列叙述正确的是
Z(g) + W(s) △H>0,下列叙述正确的是
A. 加入少量Z,逆反应速率增大
B. 当容器中气体压强不变时,反应达到平衡
C. 升高温度,平衡向逆反应方向移动
D. 平衡后,加入X,该反应的△H增大
查看答案和解析>>
科目: 来源: 题型:
【题目】氮及其化合物如NH3及铵盐、N2H4、N2O4等在中学化学、化工工业、国防等领域占有重要地位。
(1)发射航天火箭常用肼(N2H4)与N2O4作燃料与助燃剂。N2H4 (1)与N2O4(g)生成4 mol H2O(g)时放出热量1077 kJ,写出其热反应方程式:_____________________________________。
(2)N2O4与NO2之间存在反应N2O4(g)![]() 2NO2 (g)将一定量的 N2O4放入恒容密闭容器中,测得其平衡转化率[a(N2O4)]随温度的变化如图所示。
2NO2 (g)将一定量的 N2O4放入恒容密闭容器中,测得其平衡转化率[a(N2O4)]随温度的变化如图所示。
①由图推测该反应ΔH_______0(填“>”或“<”),理由为__________________________。
②图中a点对应温度下,已知N2O4的起始压强p0为108 kPa,列式计算该温度下反应的平衡常数Kp =____________。(保留一位小数,并带单位。用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)
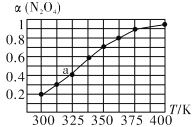
③在一定条件下,该反应N2O4、NO2两者的消耗速率与自身压强间存在关系:v消耗(N2O4)=k1· P(N2O4),v消耗(NO2)=k2·P2(NO2),其中k1、k2是与反应温度有关的速率常数。则一定温度下,k1、k2与平衡常数Kp的关系是k1=________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】在某元素的原子核外电子排布中,K电子层和L电子层的电子数之和等于M电子层和N电子层的电子数之和。则该元素的核电荷数为
A. 12 B. 17 C. 20 D. 30
查看答案和解析>>
科目: 来源: 题型:
【题目】现有下列十种物质:①Na2O ②Cu(OH)2 ③Zn ④CaCO3 ⑤硫酸溶液 ⑥Ba(OH)2 ⑦干冰 ⑧A12(SO4)3 ⑨HCl水溶液 ⑩KHSO4
(1)其中属于非电解质的有_____________(填序号)。
(2)往②中加入过量的0.1 mol/L⑩的水溶液,发生反应的离子方程式是___________,向所得溶液中继续加入③,会产生无色气泡,该反应的离子方程式是_____________________。
(3)焊接铜器时,可先用NH4Cl除去其表面的氧化铜再进行焊接,该反应可表示为:4CuO+2NH4Cl![]() 3Cu+CuCl2+N2↑+4H2O
3Cu+CuCl2+N2↑+4H2O
①用双线桥标明电子转移的方向和数目。______________________ 。
②该反应中,被氧化的元素是 ,氧化剂是__________________。
③还原剂与氧化产物的物质的量之比为_________________。
④反应中若产生0.2 mol的氮气,则有_______________mol的电子转移。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com