
科目: 来源: 题型:
【题目】甲烷是一种理想的洁净燃料,利用甲烷与水反应制备氢气,因原料廉价,具有推广价值。该反应为CH4(g)+H2O(g) ![]() CO(g)+3H2(g) △H>0
CO(g)+3H2(g) △H>0
①若800℃时,反应的化学平衡常数K=l.0,某时刻测得该温度下密闭容器中各物质的物质的量浓度如下表。
CH4 | H2O | CO | H2 |
3.0 mol·L-1 | 8.5 mol·L-1 | 2.0 mol·L-1 | 2.0 mol·L-1 |
(1)则此时正、逆反应速率的关系是__________ 。(填“>”“<”“=”)
②为了探究温度、压强对上述化学反应速率的影响,某同学设计了以下三组对比实验(温度为360℃或480℃、压强为101 kPa或303 kPa,其余实验条件见下表)。
实验序号 | 温度/℃ | 压强/kPa | CH4初始浓度/mol·L-1 | H2O初始浓度/ mol·L-1 |
1 | 360 | P | 2.00 | 6.80 |
2 | t | 101 | 2.00 | 6.80 |
3 | 360 | 101 | 2.00 | 6.80 |
(2)表中t=_________,P=_________;设计实验2、3的目的是______________;
实验l、2、3中反应的化学平衡常数的大小关系是_________(用K1、K2、K3表示)
(3)—定温度下,在容积2L且固定的两个密闭容器中,按如下方式加入反应物, 一段时间后达到平衡。
容器 | 甲 | 乙 |
反应物投入量 | 1molCH4、 1molH2O | amolCH4、 amolH2O、 b molCO、 c molH2 |
经测定甲容器经过5min达到平衡,平衡后甲中气体的压强为开始的1.2倍,甲容器中该反应在5min内的平均速率v(H2)=__________,若要使平衡后乙与甲中相同组分的体积分数相等,且起始时维持化学反应向逆反应方向进行,则b的取值范围为__________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】将1molI2和2molH2(g)置于某2L密闭容器中,在—定温度下发生反应:I2(g)+H2(g)![]() 2HI(g) △H<0,并达平衡,HI的体积分数ω(HI)随时间变化如图曲线
2HI(g) △H<0,并达平衡,HI的体积分数ω(HI)随时间变化如图曲线

(1)达平衡时,I2(g)的物质的量浓度为 _______。H2(g)的平衡转化率为___________。
在此温度下,该反应的平衡常数K__________(保留一位小数)。
(2)若改变反应条件下,在甲条件下ω(HI)的变化如图曲线(I)所示,在乙条件下ω(HI)的变化如图曲线(III)所示。则甲条件可能是______(填入下列条件的序号。下同),乙条件可能是________。
①恒容条件下,升高温度
②恒容条件下,降低温度
③恒温条件下,缩小反应容器体积
④恒温条件下,扩大反应容器体积
⑤恒温恒容条件下,加入适当催化剂
(3)若保持温度不变,在另一相同的2L密闭容器中加入a mol I2(g)、b mol H2和c mol HI(a、b、 c均大于0),发生反应,达平衡时,HI的体积分数仍为0.60,则a、b、c的应满足的关系是_______________ (用含一个a、b、c的代数式表示)
查看答案和解析>>
科目: 来源: 题型:
【题目】(1)在密闭容器中充入1molH2和1molI2,压强为P(Pa),并在—定温度下使其发生反应:H2(g)+I2(g) ![]() 2HI(g) △H<0。保持容器内气体压强不变,向其中加入1molN2,反应速率______(填“变大”、“ 变小”或“不变”),平衡_________ 移动(填“向正反应方向”、“ 向逆反应方向”或“不”)。
2HI(g) △H<0。保持容器内气体压强不变,向其中加入1molN2,反应速率______(填“变大”、“ 变小”或“不变”),平衡_________ 移动(填“向正反应方向”、“ 向逆反应方向”或“不”)。
(2)火箭残骸中存在红棕色气体,原因为:N2O4![]() 2NO2(g) △H
2NO2(g) △H
①当温度升高时,气体颜色变深,则反应为_______________( “吸热”或“放热”)反应。
②T℃,将1molN2O4充入恒压密闭容器中,下列示意图正确且能说明反应达到平衡状态是____________
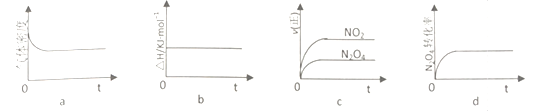
③T℃,上述反应改在体积为1L的恒容密闭容器中进行,平衡常数___________(填“增大”“ 不变”或“减小”)。
(3)已知 4HCl(g)+O2(g) ![]() 2Cl2 (g)+2H2O(g)中 2mol HCl被氧化,放出 57.8kJ 的热量,且部分化学键断裂示意图如下:
2Cl2 (g)+2H2O(g)中 2mol HCl被氧化,放出 57.8kJ 的热量,且部分化学键断裂示意图如下:
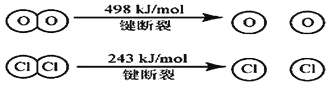
①写出该反应的热化学方程式___________________ 。
②断开1 mol H-O键与断开1 molH-C1键所需能量相差约为_________kJ,H2O中H-O键比HCl中H-Cl键___________(填“强”或“弱”)。
查看答案和解析>>
科目: 来源: 题型:
【题目】研究反应物的化学计量数与产物之间的关系时,使用类似数轴的方法可以起到直观形象的效果。下列表达不正确的是
A. 密闭容器中CuO和C高温反应的气体产物:![]()
B. Na与O2反应的产物: 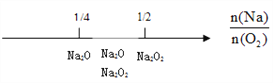
C. AlCl3溶液中滴加NaOH后铝元素的存在形式:
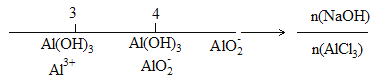
D. 氨水与SO2反应后溶液中的铵盐: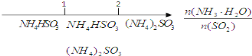
查看答案和解析>>
科目: 来源: 题型:
【题目】研究NO2、SO2、CO等大气污染气体的测量及处理具有重要意义。
(1)降低汽车尾气的方法之一是在排气管上安装催化转化器,发生如下反应:
2NO(g)+2CO(g)![]() N2(g)+2CO2(g) △H<0
N2(g)+2CO2(g) △H<0
①一定条件下,将体积比为1:2的NO、CO气体置于恒容密闭容器中发生上述反应,下列能说明反应达到平衡状态的是_________(填字母)。
A.体系压强保持不变 B.混合气体颜色保持不变
C. N2和CO2的体积比保持不变 D. v正(CO)=2v逆(N2)
②20min时,若改变反应条件,导致N2浓度发生如下图1所示的变化,则改变的条件可能是_____(填字母)。
A.加入催化剂 B.降低温度 C.增加CO2量 D.缩小容器体积
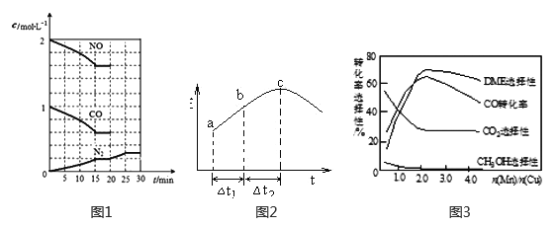
(2)在一定条件下,将SO2和NO2通入绝热恒容密闭容器中,发生反应:SO2(g)+NO2(g) ![]() SO3(g)+NO(g),正反应速率随时间变化如图2所示。由图可得出的正确结论是_____________(填字母)。
SO3(g)+NO(g),正反应速率随时间变化如图2所示。由图可得出的正确结论是_____________(填字母)。
A.反应在c点达到平衡状态
B.反应物浓度:b点小于c点
C.反应物的总能量低于生成物的总能量
D.△t1=△t2 时,SO2的转化率:a~b段小于b~c段
(3)采用一种新型的催化剂(主要成分是Cu-Mn的合金),利用CO和H2可制备二甲醚(DME)。观察图3回答问题。催化剂中n(Mn)/n(Cu)约为__________时最有利于二甲醚的合成。
(4)工业上可以用CO和H2生产燃料甲醇:CO(g)+2H2(g)![]() CH3OH(g) △H=-92.9kJ/mol, 300℃,在容积相同的3个密闭容器中,按不同方式投入反应物,保持恒温、恒容,测得反应达到平衡的有关数据如下:
CH3OH(g) △H=-92.9kJ/mol, 300℃,在容积相同的3个密闭容器中,按不同方式投入反应物,保持恒温、恒容,测得反应达到平衡的有关数据如下:
容器 | 甲 | 乙 | 丙 | |
反应物投入量 | 1molCO、2molH2 | lmolCH3OH | 2molCH3OH | |
平衡 时的 数据 | CH3OH/mol·L-1 | c1 | c2 | c3 |
反应的能量变化 | 放出akJ | 吸收bkJ | 吸收ckJ | |
体系压强/Pa | p1 | p2 | p3 | |
反应物转化率 | a1 | a2 | a3 | |
下列说法中正确的是______
A.2c1>c3 B. a+b=92.9 C.2p23 D.a1+a3<1
查看答案和解析>>
科目: 来源: 题型:
【题目】我国近海海域海水中一些元素含量普遍超标,富营养化十分严重。经常发生“赤潮”现象。下列生活用品中能引起“赤潮”的是( )
A.肥皂 B.含磷洗涤剂 C.加酶洗衣粉 D.化妆品
查看答案和解析>>
科目: 来源: 题型:
【题目】下列离子方程式与所述事实相符且正确的是
A. 漂白粉溶液在空气中失效:ClO-+CO2+H2O=HClO+HCO3-
B. 向盐酸中滴加氨水:H++OH-=H2O
C. 向NaAlO2溶液中通入过量CO2制Al(OH)3:AlO2-+CO2+2H2O= Al(OH)3↓+HCO3-
D. Fe(OH)3溶于氢碘酸:Fe(OH)3+3H+=Fe3++3H2O
查看答案和解析>>
科目: 来源: 题型:
【题目】恒温恒容下,向2L密闭容器中加入MgSO4和CO(g),发生反应:
MgSO4(s)+CO(g)![]() MgO(s)+CO2(g)+SO2(g),反应过程中测定的部分数据见下表:
MgO(s)+CO2(g)+SO2(g),反应过程中测定的部分数据见下表:
反应时间/min | n(MgSO4)/mol | n(CO)/mol | n(CO2)/mol |
0 | 2.00 | 2.00 | 0 |
2 | 0.80 | ||
4 | 1.20 |
下列说法正确的是
A. 反应在0~2min内的平均速率为v(SO2)=0.6mol·L-1·min-1
B. 反应在2~4min内容器内气体的密度没有变化
C. 若升高温度,反应的平衡常数变为1.00,则正反应为放热反应
D. 保持其他条件不变,起始时向容器中充入1.00molMgSO4和1.00molCO,到达平衡时n(CO2)>0.60mol
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com